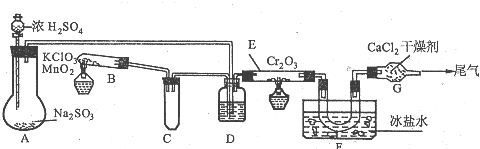
题目内容
15.如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是第三周期离子半径最小的金属元素,K是一种红棕色气体.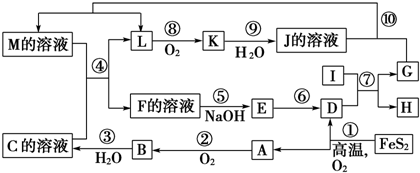
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第四周期Ⅷ族,并写出试剂NaOH的电子式
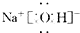
(2)在反应⑦中氧化剂与还原剂的物质的量之比为1:2.
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是③(填序号).
(4)反应④的离子方程式是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
(5)设计实验证明M中阳离子取适量Fe(NO3)2溶液于试管,滴入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液出现血红色,则证明有Fe2+离子.
(6)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
分析 由反应4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I是第三周期离子半径最小的金属元素,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3,结合对应物质的性质和题目要求解答该题.
解答 解:由反应4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,由K是一种红棕色气体,K为NO2,J为HNO3,I是第三周期离子半径最小的金属元素,反应⑦为铝单质与金属氧化物所发生的置换反应,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3,L为NO,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,反应中硝酸根有剩余,F为Fe(NO3)3或Fe2(SO4)3,E应为Fe(OH)3.
(1)由以上分析可知G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,NaOH的电子式为: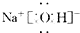 ,
,
故答案为:四;Ⅷ;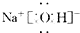 ;
;
(2)反应⑦为Al与Fe2O3所发生的置换反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化铁是氧化剂,铝是还原剂,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(3)在反应②、③、⑥、⑨中,②、⑥、⑨都为氧化还原反应,③为SO3+H2O=H2SO4的反应,既属于化合反应又属于非氧化还原反应,故答案为:③;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)实验证明M[Fe(NO3)2]中阳离子:取适量Fe(NO3)2溶液于试管,滴入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液出现血红色,则证明有Fe2+离子,
故答案为:取适量Fe(NO3)2溶液于试管,滴入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液出现血红色,则证明有Fe2+离子;
(6)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
点评 本题以工业流程图为基础,考查无机物的推断,注意根据FeS2与氧气反应的性质结合物质的反应特点和物质的物理性质进行推断,结合电子式的书写、化学方程式和离子方程式的书写、以及氧化还原反应知识的运用,并考查察了学生对实验的设计能力.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1molFe可还原2molFe3+ |
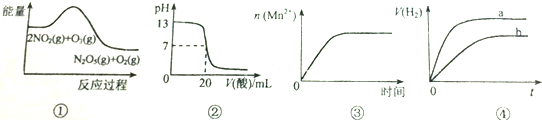
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.5mol/LCH3COOH溶液滴定20mlNaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | ③表示10ml 0.01mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| A. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| B. | 实验室制取氯气时,先装好二氧化锰,再检查装置的气密性 | |
| C. | 检验红色砖块中是否含三价铁的步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| D. | 在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |
| A. | 澄清石灰水与稀硝酸反应 | B. | 硫在氧气中燃烧 | ||
| C. | 钠粒与稀盐酸反应 | D. | 碳酸氢钠溶液与氢氧化钠溶液反应 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
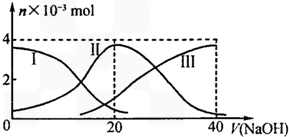 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |