题目内容
12.W是由A、B两种元素组成的AB2型化合物.(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.则W为SiO2(填化学式).
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象.
往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色.
①W溶液中所含金属阳离子为Fe2+.
②上述实验中,W与足量氯水反应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-.
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1.
①阴离子的电子式为
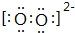 .
. ②1mol W与足量水充分反应,转移电子的物质的量为1mol.
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸.
①B在元素周期表中的位置为第二周期VIA族.
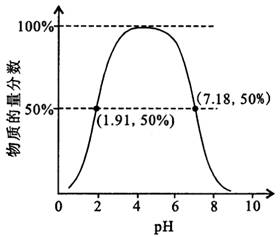
②如果常温下W为气体,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为HSO3-;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈1.91.
③如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为H2SeO3+H2O2=H2SeO4+H2O.
分析 (1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2,反应生成Si与CO;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2;
(4)①若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
②如果常温下W为气体,则A为S元素、W为SO2,含硫元素的某微粒占所有含A元素微粒的物质的量分数随溶液pH增大先增大而后降低,该微粒的化学式为HSO3-;存在平衡:H2SO3?HSO3-+H+,溶液pH=1.91时,溶液中HSO3-占50%,则溶液中c(HSO3-)≈c(H2SO3),该二元弱酸的一级电离常数为Ka1=$\frac{c({H}^{+})×c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})}$=c(H+);
③如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化生成H2SeO4.
解答 解:(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2,C与二氧化硅反应生成Si与CO,故答案为:SiO2;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2.
①W溶液中所含金属阳离子为:Fe2+,故答案为:Fe2+;
②W(FeI2)与足量氯水反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2.
①CaO2中阴离子的电子式为: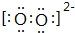 ,故答案为:
,故答案为: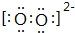 ;
;
②发生反应:2CaO2+2H2O=2Ca(OH)2+O2↑,反应中CaO2既是氧化剂又是还原剂,1mol CaO2与足量水充分反应生成0.5mol氧气,转移电子的物质的量为0.5mol×2=1mol,故答案为:1;
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
①氧元素处于周期表中第二周期VIA族,故答案为:第二周期VIA族;
②如果常温下W为气体,则A为S元素、W为SO2,含硫元素的某微粒占所有含A元素微粒的物质的量分数随溶液pH增大先增大而后降低,该微粒的化学式为HSO3-;存在平衡:H2SO3?HSO3-+H+,溶液pH=1.91时,溶液中HSO3-占50%,则溶液中c(HSO3-)≈c(H2SO3),该二元弱酸的一级电离常数为Ka1=$\frac{c({H}^{+})×c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})}$=c(H+),则pKa1=-lgKa1≈1.91,
故答案为:HSO3-;1.91;
③如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O,
故答案为:H2SeO3+H2O2=H2SeO4+H2O.
点评 本题考查无机物推断,侧重考查特殊组成物质的性质,属于并列型题目,需要学生熟练掌握元素化合物性质,难度中等.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. |  构成铜锌原电池 | B. |  电解制氢气、氯气 | ||
| C. |  中和反应热量测定 | D. |  酸碱中和滴定 |
| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |
| A. | 澄清石灰水与稀硝酸反应 | B. | 硫在氧气中燃烧 | ||
| C. | 钠粒与稀盐酸反应 | D. | 碳酸氢钠溶液与氢氧化钠溶液反应 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
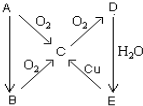 A、B、C、D、E、在一定条件下的转换条件如图所示.
A、B、C、D、E、在一定条件下的转换条件如图所示.