题目内容
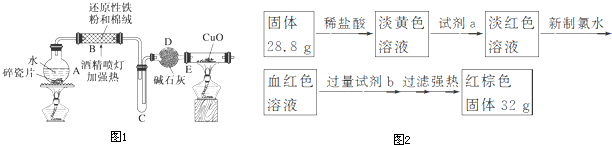
10.某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:探究一 设计如图1所示装置进行“铁与水反应”的实验.
(1)硬质玻璃管B中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)反应前A中投放碎瓷片的目的是防止暴沸.
(3)装置E中的现象是黑色固体变红,右端管壁有水珠.
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分.
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于稀硫酸后,将所得溶液分成两份.
(5)一份滴加几滴KSCN溶液.若溶液变血红色,推断硬质玻璃管B中固体物质的成分为①(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为②.
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
(6)另一份用胶头滴管(填仪器名称)加入酸性KMnO4溶液溶液褪色,可以证明溶液中存在Fe2+.
探究三 设计如下流程(如图2)测定反应后硬质玻璃管B中固体含铁元素的质量分数.
(7)试剂b的化学式是NaOH.
(8)计算反应后B装置中铁元素的质量分数为77.8%.
分析 【探究一】(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,据此写出反应的化学方程式;
(2)给液体加热时容易发生暴沸现象,加入碎瓷片可防止暴沸;
(3)装置E中氢气还原黑色的氧化铜,反应生成红色的铜单质和水;
【探究二】在验证反应后黑色固体的成分时,检验Fe3+,最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+,可用酸性KMnO4溶液.由于酸性KMnO4溶液与盐酸发生反应,所以在溶解反应后的黑色固体时,不能用盐酸,也不能用硝酸(因为HNO3可氧化Fe2+),可用稀硫酸,据此解答(4)(5)(6);
【探究三】(7)由“红棕色固体”知,该物质为Fe2O3,反应转化关系为:FeCl3$\stackrel{NaOH}{→}$Fe(OH)3和NaCl,则试剂b为NaOH溶液;
(8)氧化铁的质量为:m(Fe2O3)=32g,根据n=$\frac{m}{M}$计算出氧化铁的物质的量,再根据铁元素守恒计算出铁的物质的量、质量,最后计算出反应后B装置中铁元素的质量分数.
解答 解:【探究一】(1)硬质管中铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)液体加热时容易发生暴沸现象,加入碎瓷片的作用是防止暴沸,
故答案为:防止暴沸;
(3)装置E中发生反应为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,则反应现象是:黑色固体变红,右端管壁有水珠,
故答案为:黑色固体变红,右端管壁有水珠;
【探究二】在验证反应后黑色固体的成分时,检验Fe3+,最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+,可用酸性KMnO4溶液.由于酸性KMnO4溶液与盐酸发生反应,所以在溶解反应后的黑色固体时,不能用盐酸,也不能用硝酸(因为HNO3可氧化Fe2+),可用稀硫酸,
(4)根据分析可知,溶解反应后固体需要用稀硫酸,
故答案为:稀硫酸;
(5)一份滴加几滴KSCN溶液,若溶液变血红色,说明溶液中含有铁离子,则可推断硬质玻璃管B中固体物质的成分为:①一定有Fe3O4;
若溶液未变血红色,则溶液中不存在铁离子,可推断硬质玻璃管B中固体物质中一定存在Fe,即②正确,
故答案为:①;②;
(6)检验亚铁离子,需要用胶头滴管加入酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则证明溶液中含有亚铁离子,
故答案为:胶头滴管;酸性KMnO4溶液,溶液褪色;
【探究三】(7)由“红棕色固体”知,该物质为Fe2O3,则FeCl3$\stackrel{NaOH}{→}$Fe(OH)3和NaCl,过滤后加强热生成红棕色固体,则试剂b为NaOH溶液,
故答案为:NaOH;
(8)氧化铁的质量为:m(Fe2O3)=32g,则氧化铁的物质的量为:n(Fe2O3)=$\frac{32g}{160g/mol}$=0.2mol,则含有铁元素的物质的量为:n(Fe)=0.4mol,则反应后B装置中铁元素的质量分数为:$\frac{56g/mol×0.4mol}{28.8g}$×100%≈77.8%,
故答案为:77.8%.
点评 本题通过铁及其化合物性质考查了探究物质组成、测量物质含量的方法,题目难度中等,注意掌握探究实验的设计方法,明确铁及其化合物性质,试题涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、进行计算能力.

| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
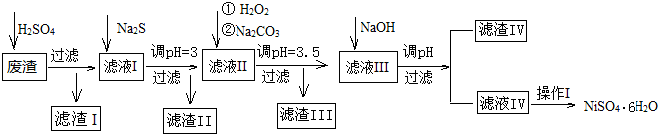
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作Ⅰ包括以下过程:冷却、结晶、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用酒精洗涤,目的是既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失.干燥有低温干燥和高温干燥,能否用高温干燥否,理由是温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水.
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=2.5×1013.{已知:25℃时,KSP[Mg(OH)2]=5.0×10-14;KSP[Al(OH)3]=2.0×10-33}.
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1molFe可还原2molFe3+ |
| A. | Na2SO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
| A. |  构成铜锌原电池 | B. |  电解制氢气、氯气 | ||
| C. |  中和反应热量测定 | D. |  酸碱中和滴定 |
| A. | 简单氢化物的热稳定性:Z>W | B. | 最高价氧化物的水化物的酸性:X<Z | ||
| C. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | D. | 沸点:XW2>Y2W |
| 温度/℃ | N(B)/mol | N(D)/mol |
| T1 | 0.60 | - |
| T2 | - | 0.35 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{4}{9}$ | |
| C. | T2℃时,若反应达到平衡后再缩小容器的体积,c(C):c(D)不变 | |
| D. | T1℃时,若开始时反应物的用量均减小一半,平衡后A的转化率α(A)减小 |