题目内容
4.以下是同学们在探讨金属及其化合物性质和应用时进行的探究实验:士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量.下面是在相同的室温下(约20℃)对该产品的两份实验:
I.向加有等量水的隔热容器中分别加入下列各组物质,结果参见图1.
①1.0mol镁一整根、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、n1mol铁粉、0.10mol氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mol氯化钠粉末;

II.向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠
粉末,不断搅拌,第15min时记录温度升高的幅度参见图2.
请回答下列问题:
(1)如果实验Ⅰ只验证了一种外因对镁与水反应速率的影响,则该因素是D.
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
由此确定n1=0.10
(2)实验Ⅱ中当NaCl的用量大于0.125mol时,实验就无须再做的原因是C.
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于D.
A.34℃B.42℃C.50℃D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率.
分析 (1)根据实验Ⅰ中三组物质不同之处判断实验目的;
(2)结合图2可知,NaCl用量达到0.125 mol时,溶液达到沸腾状态,再增加NaCl的用量时,温度不再发生变化;
(3)根据图2当加入0.06 mol NaCl时记录的温度进行判断;
(4)根据镁粉、铁粉与NaCl水溶液共同构成了原电池的角度进行分析.
解答 解:(1)实验1中三组物质不同之处在于镁的状态,故实验Ⅰ是研究的是镁的表面积与速率的关系,故D正确;对照试验中其它因素必须完全相同,则铁粉的物质的量n1=0.10,
故答案为:D;0.10;
(2)根据图2可知,NaCl用量达到0.125 mol时,溶液已经达到沸腾状态,当NaCl的用量再增加时,温度不再发生变化,所以无需再做,所以C正确,
故答案为:C;
(3)由图2可见,当加入0.06 mol NaCl时,第15 min记录的温度升高值在42℃左右,所以则第15min时混合物的温度最接近于:42℃+20℃=62℃,则D正确,
故答案为:D;
(4)镁粉、铁粉与NaCl水溶液共同构成了原电池,大大促进了Mg的反应,加快了反应的速率,
故答案为:镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,注意掌握温度、固体表面积、浓度等影响化学反应速率的因素,(4)中注意构成原电池后对反应速率的影响,试题培养了学生的分析、归纳能力及化学实验能力.

练习册系列答案
相关题目
9.有关天然物质水解叙述不正确的是( )
| A. | 氨基酸既显酸性又显碱性 | |
| B. | 可用碘水检验淀粉是否水解完全 | |
| C. | 变质的油脂有难闻的气味,是由于油脂发生了水解反应 | |
| D. | 纤维素水解和淀粉水解得到的最终产物相同 |
13.下列说法正确的是( )
| A. | 氢氧化钠是离子化合物,该物质中只存在离子键 | |
| B. | 干冰在升华的过程中,只需要克服分子间作用力 | |
| C. | 12 C与 13 C由于核外电子排布不同,所以属于同位素 | |
| D. | 在 N2、CO2 和 SiO2 三种物质中,都存在共价键,它们都是由分子构成的物质 |
14.判断下列有关说法中错误的是( )
| A. | SiCl4是分子晶体 | B. | 单质B是原子晶体 | C. | AlCl3是离子晶体 | D. | MgCl2离子晶体 |
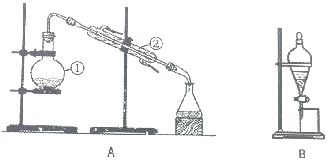 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.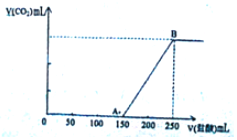 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示