题目内容
12.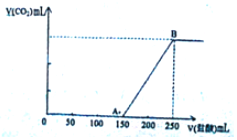 向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
向100mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示(1)写出OA段发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3-.
(2)反应到B点时所得溶液中的溶质是NaCl.
(3)原NaOH溶液的物质的量浓度是2.5mol/L.
分析 当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗盐酸250mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗盐酸125mL,而图象中开始生成CO2气体时消耗盐酸150mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,据此进行解答.
(1)根据分析书写发生反应的离子方程式;
(2)生成气体达到最大时,反应后溶质为氯化钠;
(3)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算氢氧化钠的浓度.
解答 解:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗盐酸250mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗盐酸125mL,而图象中开始生成CO2气体时消耗盐酸150mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,
(1)由上述分析可知OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3-,
故答案为:H++OH-═H2O、CO32-+H+═HCO3-;
(2)生成CO2气体最大时,此时溶液中溶质为NaCl,
故答案为:NaCl;
(4)生成CO2气体最大时,溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.25L×1mol/L=0.25mol,则原氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.25mol}{0.1L}$=2.5mol/L,
故答案为:2.5mol/L.
点评 本题考查化学反应方程式的计算,题目难度中等,注意图象与反应的对应关系,侧重学生分析判断和计算能力的考查,注意图象中B点溶液溶质的判断.

 阅读快车系列答案
阅读快车系列答案| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |
| A. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 | |
| B. | 使用填埋法处理未经分类的生活垃圾 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 加速建设地铁、轻轨等轨道交通,促进武汉“8+1”城市圈-体化发展,减少汽车尾气排放 |
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(D)=1 mol/(L•s) |
| A. | Ca | B. | Fe | C. | Cu | D. | P |
