题目内容
19.将8.7gMnO2加入到的足量的浓盐酸中,试计算可以收集氯气多少L(标准状况)?分析 依据化学方程式结合二氧化锰计算得到氯气标准状况下的体积.
解答 解:8.7g的MnO2与物质的量=$\frac{8.7g}{87g/mol}$=0.1mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,得到生成氯气0.1mol,标准状况下体积为22.4L/mol×0.1mol=2.24L,
答:收集氯气2.24L.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量关系即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列是一些装置气密性检查的方法,其中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
10.下列离子方程式中能表示多个化学反应的是( )
①Fe+Cu2+═Fe2++Cu ②Ba2++OH-+H++SO42-═BaSO4↓+H2O
③Ba2++OH-+H++SO42-═BaSO4↓+2H2O ④Cl2+H2O═H+Cl-+HClO
⑤CO32-+2H+═CO2+H2O ⑥Ag++Cl-═AgCl↓
①Fe+Cu2+═Fe2++Cu ②Ba2++OH-+H++SO42-═BaSO4↓+H2O
③Ba2++OH-+H++SO42-═BaSO4↓+2H2O ④Cl2+H2O═H+Cl-+HClO
⑤CO32-+2H+═CO2+H2O ⑥Ag++Cl-═AgCl↓
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
7.下列有关说法正确的是( )
| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |
14.下列有关化学用语及其叙述,不正确的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: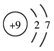 | D. | -OH的电子式: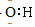 |
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol FeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
9.下列离子方程式的书写不正确的是( )
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
