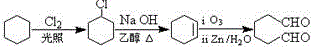
题目内容
14.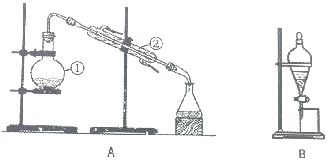 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.(1)A 图所示的操作名称是蒸馏,仪器②的名称是冷凝管,用此操作制取蒸馏水,还缺少的一种仪器是酒精灯,①中加入少量碎瓷片的作用是防暴沸,将仪器补充完整后进行试验若试验过程中发现忘加碎瓷片,应采取的正确操作是停止实验,待装置冷却至室温时加入碎瓷片,重新开始实验;
(2)用B 图所示装置将碘从水溶液中萃取出来,可用CCl4作为萃取剂;混合、振荡、静止一段时间后,观察到的现象是液体分层,下层液体为紫色(液体分层,上层液体为紫色);分液时水层应从分液漏斗的上口(填“上”或“下”)流出,实验过程中为保证液体顺利流下,应进行的具体操作是将分液漏斗颈上的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔.
分析 (1)装置A为蒸馏操作,其中仪器②起到冷凝作用,名称为冷凝管;蒸馏时必须使用加热仪器,图示装置中缺少酒精灯;给混合液加热时易发生爆沸现象,需要加入碎瓷片防止暴沸;若试验过程中发现忘加碎瓷片,需要停止加热,冷却后重新补加碎瓷片;
(2)可用四氯化碳作催化剂除去碘水中的碘单质;四氯化碳密度较大,有机层在下层、水层在上层,上层液体从分液漏斗的上口倒出;保证液体顺利流下,需要将分液漏斗的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔.
解答 解:(1)根据图示可知,装置A为蒸馏,其中仪器②的名称为冷凝管;蒸馏时需要加热仪器,图示装置中还缺少的仪器为酒精灯;蒸馏时混合液加热易发生爆沸现象,需要加入碎瓷片防暴沸;若试验过程中发现忘加碎瓷片,需要后重新补加碎瓷片,操作方法为:停止实验,待装置冷却至室温时加入碎瓷片,重新开始实验,
故答案为:蒸馏;冷凝管;酒精灯;防暴沸;停止实验,待装置冷却至室温时加入碎瓷片,重新开始实验;
(2)碘单质易溶于CCl4,可用CCl4作催化剂除去碘水中的碘单质;CCl4密度大于水,则有机层在下层、水层在上层,分液时水层应从分液漏斗的上口倒出;
实验过程中为保证液体顺利流下,需要保证分液漏斗内外压强相等,操作方法为:需要将分液漏斗的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔,
故答案为:CCl4;液体分层,下层液体为紫色(液体分层,上层液体为紫色);上;将分液漏斗颈上的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔.
点评 本题考查了物质分离与提纯实验方案的设计,题目难度不大,涉及蒸馏、分液等操作,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
11.某化学小组对Na2SO3和AgNO3在不同pH下的反应及产物,进行了以下实验探究.
查阅资料:Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应.
(1)根据资料:
①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是产生白色浑浊.
②若Ag2O与盐酸反应,其化学方程式应为Ag2O+2HCl=2AgCl+H2O.
(2)检测溶液pH:
①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是Ag+.
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是SO32-+H2O=HSO3-+OH-.
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应.实验记录如图:
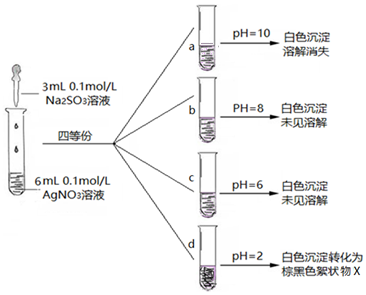
Ⅰ.实验a中沉淀溶解消失的原因,可能是Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解.
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是6-8.
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
①由实验ⅰ得出的结论是黑棕色沉淀不是Ag2O.
②d中的棕黑色絮状物X是Ag.
③实验ⅱ中的化学反应方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(4)小组认为在酸性条件下,SO32-的还原性增强,生成X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
查阅资料:Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应.
(1)根据资料:
①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是产生白色浑浊.
②若Ag2O与盐酸反应,其化学方程式应为Ag2O+2HCl=2AgCl+H2O.
(2)检测溶液pH:
①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是Ag+.
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是SO32-+H2O=HSO3-+OH-.
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应.实验记录如图:

Ⅰ.实验a中沉淀溶解消失的原因,可能是Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解.
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是6-8.
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
②d中的棕黑色絮状物X是Ag.
③实验ⅱ中的化学反应方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(4)小组认为在酸性条件下,SO32-的还原性增强,生成X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
9.下列是一些装置气密性检查的方法,其中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
19.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入 3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是 0.4 mol | |
| C. | 参加反应的金属的总质量 9.6g>m>3.6g | |
| D. | 当金属全部溶解时收集到 NO气体的体积一定为2.24L |
6.为提高中和热测定的准确性,下列措施不合理的是( )
| A. | 用两只量筒分别量取所需氢氧化钠和盐酸 | |
| B. | 两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度 | |
| C. | 仪器装置保温隔热的效果要好,且操作动作要迅速 | |
| D. | 所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等 |

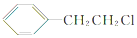 ,B的名称为苯乙烯.
,B的名称为苯乙烯.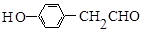 .
.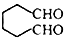 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.