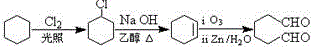
题目内容
15.用4.35gMnO2与40 mL10mol/L的浓盐酸反应,即MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O,向反应后的溶液中加入过量的AgNO3溶液.求:(1)标准状况下生成氯气的体积;
(2)生成AgCl沉淀的质量.
分析 (1)根据n=$\frac{m}{M}$计算出二氧化锰的物质的量,再根据n=cV计算出100mL12mol/L浓盐酸中含有HCl的物质的量,结合反应方程式判断过量情况,根据不足量计算出生成氯气的物质的量,最后根据V=nVm计算出生成氯气在标准状况下的体积;
(2)加入过量硝酸银溶液反应生成AgCl沉淀,根据Cl元素守恒可计算出生成氯化银的物质的量,然后根据m=nM计算出生成氯化银的质量.
解答 解:(1)4.35gMnO2的物质的量为:$\frac{4.35g}{87g/mol}$=0.05mol,40mL 10mol/L浓盐酸中含有HCl的物质的量为:10mol/L×0.04L=0.4mol,
根据反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,0.05mol二氧化锰完全反应消耗HCl的物质的量为:0.05mol×4=0.20mol<0.40mol,说明浓盐酸过量,生成的氯气按照二氧化锰的量计算,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 1
0.05mol n(Cl2)
则生成氯气的物质的量为0.05mol,标准状况下0.05mol氯气的体积为:22.4L/mol×0.05mol=1.12L,
答:标准状况下生成Cl2的体积为1.12L;
(2)反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中HCl被氧化生成氯气,根据Cl元素守恒可知发生氧化反应的HCl的物质的量为n(HCl)=2n(Cl2)=0.05mol×2=0.1mol,
40mL 10mol/L浓盐酸中含有HCl的物质的量为0.4mol,被氧化生成氯气的HCl的物质的量为0.1mol,则反应后溶液中含有氯离子的物质的量为0.4mol-0.1mol=0.3mol,
根据Cl元素守恒可知生成AgCl的物质的量为0.3mol,质量为:143.5g/mol×0.3mol=43.05g,
答:向反应后的溶液中加入过量的AgNO3溶液,则能生成43.05g AgCl白色沉淀.
点评 本题考查化学方程式的计算,题目难度中等,明确氧化还原反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

 习题精选系列答案
习题精选系列答案| A. | 用两只量筒分别量取所需氢氧化钠和盐酸 | |
| B. | 两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度 | |
| C. | 仪器装置保温隔热的效果要好,且操作动作要迅速 | |
| D. | 所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等 |
①Fe+Cu2+═Fe2++Cu ②Ba2++OH-+H++SO42-═BaSO4↓+H2O
③Ba2++OH-+H++SO42-═BaSO4↓+2H2O ④Cl2+H2O═H+Cl-+HClO
⑤CO32-+2H+═CO2+H2O ⑥Ag++Cl-═AgCl↓
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |
| A. | 浓硝酸 | B. | 硝酸银 | C. | 氯水 | D. | 氨水 |

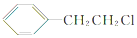 ,B的名称为苯乙烯.
,B的名称为苯乙烯.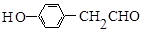 .
.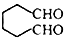 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.