题目内容
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为-57.3kJ?mol-1,辛烷的标准燃烧热为-5518kJ?mol-1.下列热化学方程式书写正确的是( )
| A、2H+(aq)+SO42- (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 | ||
| B、2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 | ||
C、C8H18(1)+
| ||
D、C8H18(g)+
|
考点:热化学方程式
专题:化学反应中的能量变化
分析:25℃,101k Pa时,强酸、强碱的稀溶液反应生成可溶性盐且生成1mol水时放出的热量为57.3kJ,燃烧热概念中可燃物的物质的量必须是1mol,且生成稳定的氧化物,据此分析解答.
解答:
解:25℃,101k Pa时,强酸、强碱的稀溶液反应生成可溶性盐且生成1mol水时放出的热量为57.3kJ,燃烧热概念中可燃物的物质的量必须是1mol,且生成稳定的氧化物,
A.该反应中硫酸钡不是可溶性盐,所以该反应生成2mol水放出的热量不是114.6 kJ,故A错误;
B.水的计量数是2,所以△H=-114.6kJ?mol-1,故B错误;
C.该反应中可燃物的计量数是1且生成的氧化物都是稳定氧化物,所以其燃烧热化学反应方程式为C8H18(1)+
O2(g)=8CO2(g)+9 H2O(1)△H=-5518 kJ?mol-1,故C正确;
D.该条件下水蒸气不是稳定氧化物,液态水是H元素的稳定氧化物,故D错误;
故选C.
A.该反应中硫酸钡不是可溶性盐,所以该反应生成2mol水放出的热量不是114.6 kJ,故A错误;
B.水的计量数是2,所以△H=-114.6kJ?mol-1,故B错误;
C.该反应中可燃物的计量数是1且生成的氧化物都是稳定氧化物,所以其燃烧热化学反应方程式为C8H18(1)+
| 25 |
| 2 |
D.该条件下水蒸气不是稳定氧化物,液态水是H元素的稳定氧化物,故D错误;
故选C.
点评:本题考查中和热、燃烧热,侧重考查对基本概念的理解,注意这两个概念中限制性定语,此处知识点还常常易中和热的测定方式考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如图转化关系:甲
乙
丙.下列有关物质的推断不正确的是( )
| 丁 |
| 丁 |
| 甲 |
| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为NaAlO2,则丁可能是盐酸 |
| C、若甲为NaOH溶液,则丁可能是CO2 |
| D、若甲为Fe,则丁可能是盐酸 |
下列有关工业生产的叙述正确的是( )
| A、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| B、硫酸工业中,接触室内安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C、氯碱工业中,使用离子交换膜可防止C12和NaOH溶液反应 |
| D、电镀工业中,必需将镀件与电源的负极相连 |
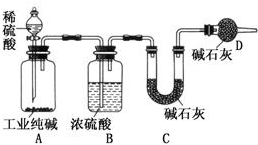 工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
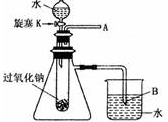 用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来.
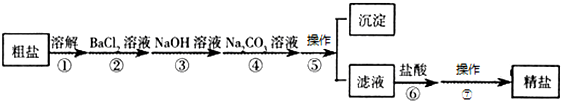
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来. 海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图: