题目内容
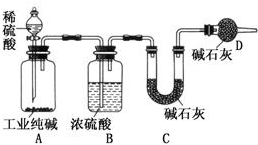 工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:试回答下列问题:
(1)装置A中发生反应的化学方程式为:
(2)装置D的作用是
(3)利用上述装置进行实验,即使气密性良好,并缓慢滴加了过量的稀硫酸使反应完全,装置C中装有足量碱石灰,其他操作也正确,测定结果还是偏低,原因可能是:
(4)实验前所取工业纯碱质量为mg,装置C中碱石灰和U形管的总质量为m1g,加入足量稀硫酸,反应结束后,装置C中碱石灰和U形管的总质量变为m2g,则上述实验中测得的工业纯碱中Na2CO3的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:实验实验原理是:纯碱和稀硫酸反应生成二氧化碳气体,经浓硫酸干燥后被碱石灰吸收,根据二氧化碳的质量可确定纯碱的含量,但本题实验存在缺陷,即装置内残留的二氧化碳不能被完全吸收,C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,以此解答该题.
解答:
解:(1)纯碱和稀硫酸反应生成二氧化碳气体,发生反应为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,干扰碳酸钠含量的测定,故答案为:防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(3)装置A、B中残留的二氧化碳不能被完全吸收,应通入氮气将二氧化碳赶出,否则会导致含量偏小,
故答案为:反应产生的CO2在装置A、B中有残留或者CO2未能被装置C中的碱石灰完全吸收;
(4)装置C中碱石灰吸收的为二氧化碳,m(CO2)=(m2-m1)g,n(Na2CO3)=n(CO2)=
mol,m(Na2CO3)=
g,
所以工业纯碱中Na2CO3的质量分数为
×100%,
故答案为:
×100%.
(2)C连接D可防止空气中水、二氧化碳进入C中,导致实验结果偏大,干扰碳酸钠含量的测定,故答案为:防止空气中的CO2、H2O进入U形管,干扰碳酸钠含量的测定;
(3)装置A、B中残留的二氧化碳不能被完全吸收,应通入氮气将二氧化碳赶出,否则会导致含量偏小,
故答案为:反应产生的CO2在装置A、B中有残留或者CO2未能被装置C中的碱石灰完全吸收;
(4)装置C中碱石灰吸收的为二氧化碳,m(CO2)=(m2-m1)g,n(Na2CO3)=n(CO2)=
| m2-m1 |
| 44 |
| 106(m2-m1) |
| 44 |
所以工业纯碱中Na2CO3的质量分数为
| 106(m2-m1) |
| 44m |
故答案为:
| 106(m2-m1) |
| 44m |
点评:本题考查物质的含量的测定的实验设计,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,难度中等.

练习册系列答案
相关题目
25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为-57.3kJ?mol-1,辛烷的标准燃烧热为-5518kJ?mol-1.下列热化学方程式书写正确的是( )
| A、2H+(aq)+SO42- (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 | ||
| B、2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 | ||
C、C8H18(1)+
| ||
D、C8H18(g)+
|
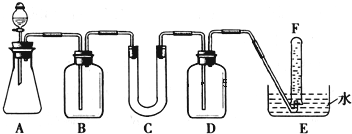
 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是