题目内容
3.向200mL0.1mol•L-1的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
| A. | 1.44 g | B. | 1.6 g | C. | 2.82 g | D. | 4.36 g |
分析 Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+完全沉淀,得到硝酸钠与氢氧化亚铁,过滤,小心加热沉淀,再灼烧至质量不再变化,由于氢氧化亚铁易被氧化,最终所得固体为Fe2O3,由Fe原子守恒可知:n[Fe(NO3)2]=2n(Fe2O3),再根据m=nM计算.
解答 解:Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+完全沉淀,得到硝酸钠与氢氧化亚铁,过滤,小心加热沉淀,再灼烧至质量不再变化,由于氢氧化亚铁易被氧化,最终所得固体为Fe2O3,200mL 0.1mol/L的Fe(NO3)2溶液中n[Fe(NO3)2]=0.2L×0.1mol/L=0.02mol,由Fe原子守恒可知:n[Fe(NO3)2]=2n(Fe2O3),所以n(Fe2O3)=$\frac{0.02mol}{2}$=0.01mol,其质量为0.01mol×160g/mol=1.6g,
故选B.
点评 本题考查化学反应方程式的计算,注意氢氧化亚铁不稳定性,关键是判断最终固体为氧化铁,利用守恒法计算,侧重考查学生分析计算能力,题目难度中等.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
3.下列关于离子化合物的叙述正确的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 离子化合物一定不能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
20.25℃时,下列关系式正确的是( )
| A. | pH=2的CH3COOH 溶液与pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(CH3COOH) | |
| B. | pH=3的H2C2O4溶液:c(H+)═c(HC2O4-)+c(OH-)=1×10-3mol/L | |
| C. | pH相同的①NH4HSO4、②NH4Cl、③(NH4)2SO4三种溶液的c(NH4+):③>①>② | |
| D. | 盐酸与FeCl3的混合溶液pH=2,稀释10倍后:pH<3 |
7.往溶液中加入 KSCN,溶液呈血红色,则该溶液中一定含有( )
| A. | Fe3+ | B. | NH4+ | C. | OH- | D. | Cl- |
8.加热N2O5,依次发生分解反应:①N2O5(g)?N2O3(g)+O2(g)、②N2O3(g)?N2O(g)+O2(g).在体积为2L的恒容密闭容器中充入8mol N2O5,加热到T℃时O2和N2O3的物质的量分别为9mol、3.4mol,则T℃时$\frac{c({N}_{2}{O}_{3})•c({O}_{2})}{c({N}_{2}{O}_{5})}$为( )
| A. | 10.7 | B. | 8.5 | C. | 9.6 | D. | 10.2 |
15.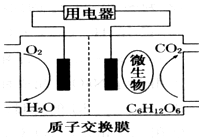 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | O2在正极反应 | |
| C. | H+通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
13.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )
| A. | 将1molCl2溶入足量的水中,溶液里HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 3.4g NH3中共用电子对数为0.6NA | |
| C. | 相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等 | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |