题目内容
15.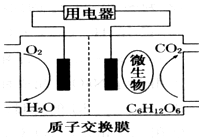 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | O2在正极反应 | |
| C. | H+通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
分析 由图可知,负极上C6H12O6失去电子生成CO2,正极上O2得到电子生成H2O,负极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极反应式为O2+4e-+4H+═2H2O,以此来解答.
解答 解:A.负极上有CO2生成,故A错误;
B.O2在正极反应,发生还原反应生成水,故B正确;
C.原电池中阳离子向正极移动,则H+通过交换膜从负极区移向正极区,故C正确;
D.由负极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极反应式为O2+4e-+4H+═2H2O,可知电池总反应为C6H12O6+6O2═6CO2+6H2O,故D正确;
故选A.
点评 本题考查化学新型电池,为高频考点,把握图中电极反应产物及电极反应为解答的关键,侧重分析与应用能力的考查,注意原电池的工作原理及图中C、O元素的化合价变化,题目难度不大.

练习册系列答案
相关题目
14.化学式为C7H12的链烃,其结构简式中不可能是( )
| A. | 只有一个“-CH3” | B. | 只有一个“ ” ” | C. | 只有一个“ ” ” | D. | 有4个“-CH2-” |
15.常温下,关于下列溶液的说法错误的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-10mol/L,则该溶液的pH可能为4或10 | |
| B. | 已知0.1 mol/L NaClO溶液的pH为9.7,0.1 mol/LNaF溶液的pH为7.5,则等体积两溶液中离子总数大小关系为:N(NaClO)>N(NaF) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/LNaOH溶液等体积混合后溶液pH大于7,则所得溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | 向饱和氯水中加入NaOH溶液至pH=7,则所得溶液中:c(Na+)>c(Cl-)>c(C1O-)>c(OH-)=c(H+) |
3.向200mL0.1mol•L-1的Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热
沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
| A. | 1.44 g | B. | 1.6 g | C. | 2.82 g | D. | 4.36 g |
10.下列化学用语表达正确的是( )
| A. | 中子数为10的氧原子:${\;}_{10}^{18}$O | B. | 羟基的电子式: | ||
| C. | Na2S的电子式: | D. | CO2的结构式:O-C-O |
7.检验下列物质的试剂、现象都正确的是( )
| 选项 | 被检验的物质 | 使用的试剂或方法 | 实验现象 |
| A | Fe3+ | KSCN溶液 | 溶液出现血红色沉淀 |
| B | SO2 | 品红溶液 | 品红溶液褪色,加热不能复原 |
| C | Na+ | 用铂丝蘸取少量溶液在火焰上灼烧 | 透过蓝色钴玻璃看到紫色火焰 |
| D | NH4+ | NaOH溶液、石蕊试纸 | 加入NaOH溶液后加热,产生的气体使湿润的红色石蕊试纸变蓝 |
| A. | A | B. | B | C. | C | D. | D |
5. 已知图一表示的是可逆反应A(g)+B(g)?C(s)+D(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间t的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应A(g)+B(g)?C(s)+D(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间t的变化情况.下列说法中正确的是( )
 已知图一表示的是可逆反应A(g)+B(g)?C(s)+D(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间t的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应A(g)+B(g)?C(s)+D(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间t的变化情况.下列说法中正确的是( )| A. | 若图一t2时改变的条件是增大压强,则反应的△H增大 | |
| B. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| C. | 图二t1时改变的条件可能是升高了温度或增大了压强 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |