题目内容
12.甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的成的常见气体X能使湿润的红色石蕊试纸变蓝;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐Y也能与戊的气态氢化物Z的水溶液反应生成盐;甲、丙可组成化合物M.请回答下列问题.(1)戊离子的结构示意图为
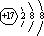 .乙的单质的电子式为
.乙的单质的电子式为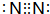 .
.(2)丙、丁、戊的简单离子半径由大到小顺序为Cl->Na+>Al3+(用离子符合表示),X的沸点比Z的沸点高的原因是氨分子间存在氢键.
(3)戊的单质与过量X混合可观察到白烟,反应的化学方程式为3Cl2+8NH3═6NH4Cl+N2,反应中被氧化的物质与被还原的物质的物质的量之比为2:3.
(4)写出少量Z的稀溶液滴入过量Y的稀溶液中发生反应的离子方程式:AlO2-+H++H2O═Al(OH)3↓.
(5)M晶体类型为离子化合物.M与X在一定条件下反应生成甲的单质和一种由甲、乙、丙三元素组成的化合物.写出该反应的化学方程式:NaH+NH3═H2↑+NaNH2 .
分析 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使润的红色石蕊试纸变蓝,则X为NH3,甲为H元素,乙为N元素;甲、丙处于同一主族,丙的原子序数大于N,故丙为Na;丙、丁、戊处于同一周期,即处于第三周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和,则戊最外层电子数=1+5+1,则戊为Cl;丁的单质既能与丙元素最高价氧化物的水化物(NaOH)的溶液反应生成盐Y,也能与戊的气态氢化物Z(HCl)的水溶液反应生成盐,丁为两性金属,则丁为Al元素,Y为NaAlO2;甲、丙可组成化合物M为NaH,据此解答.
解答 解:甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、乙组成的常见气体X能使润的红色石蕊试纸变蓝,则X为NH3,甲为H元素,乙为N元素;甲、丙处于同一主族,丙的原子序数大于N,故丙为Na;丙、丁、戊处于同一周期,即处于第三周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和,则戊最外层电子数=1+5+1,则戊为Cl;丁的单质既能与丙元素最高价氧化物的水化物(NaOH)的溶液反应生成盐Y,也能与戊的气态氢化物Z(HCl)的水溶液反应生成盐,丁为两性金属,则丁为Al元素,Y为NaAlO2;甲、丙可组成化合物M为NaH.
(1)Cl-的结构示意图为: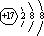 ,乙的单质为N2,电子式为
,乙的单质为N2,电子式为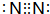 ,
,
故答案为: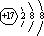 ;
;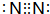 ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->Na+>Al3+;
氨气分子之间存在氢键,HCl分子之间为范德华力,氢键比较范德华力更强,故氨气的沸点更高,
故答案为:Cl->Na+>Al3+;氨分子间存在氢键;
(3)氯气与过量氨气混合可观察到白烟,反应生成氮气与氯化铵,反应方程式为:3Cl2+8NH3═6NH4Cl+N2,在反应中氨气做还原剂,氯气做氧化剂,被氧化的物质氨气只占反应掉的$\frac{1}{4}$,被氧化的物质氨气与被还原的物质氯气物质的量之比=8×$\frac{1}{4}$:3=2:3,
故答案为:3Cl2+8NH3═6NH4Cl+N2;2:3;
(4)将少量的盐酸滴入过量NaAlO2溶液中发生反应的离子方程式为AlO2-+H++H2O═Al(OH)3↓,
故答案为:AlO2-+H++H2O═Al(OH)3↓;
(5)M为NaH,属于离子晶体,NaH与NH3在一定条件下反应生成甲的单质(氢气)和一种由甲、乙、丙三元素组成的化合物,该化合物为NaNH2,该反应的化学方程式:NaH+NH3═H2↑+NaNH2 ,
故答案为:离子化合物;NaH+NH3═H2↑+NaNH2 .
点评 本题考查元素化合物的推断,X与丁的性质是推断突破口,(5)为易错点、难点,中学基本不涉及金属氢化物,侧重考查学生分析推理与知识迁移应用,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 达到化学平衡状态时,4v正(O2)=5V逆(NO) | |
| B. | 化学反应速率的关系为2V正(NH3)=3V正(H2O) | |
| C. | 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
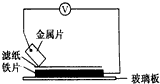 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.