题目内容
16.向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是( )| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
分析 过氧化钠与水反应生成氢氧化钠,溶液中钠离子增多,氢氧化钠与FeCl3、FeCl2、AlCl3反应,产物再与过量的盐酸反应.
解答 解:过氧化钠与水反应的方程式为:2Na2O2+2H2O═4NaOH+O2,溶液中钠离子增多,故A错误;
氢氧化钠分别与FeCl3、FeCl2、AlCl3反应的方程式为:
FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,
AlCl3(过量)+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH═NaAlO2+2H2O,
从方程式看出分别生成氢氧化铁沉淀、氢氧化亚铁沉淀、偏铝酸钠,偏铝酸钠与过量的盐酸反应生成铝离子,铝离子数目没有变化.故B正确;
生成氢氧化亚铁与空气中氧气反应全部生成氢氧化铁反应为4Fe(OH)2+2H2O+O2═4Fe(OH)3.然后再加入过量的盐酸,氢氧化铁与盐酸反应生成氯化铁,三价铁离子数目增多,二价铁离子为零.故C、D错误;
故选B.
点评 本题主要考查了二价铁离子和三价铁离子间的相互转化,解题时需灵活运用有关化学反应方程式.

练习册系列答案
相关题目
6.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡状态时,4v正(O2)=5V逆(NO) | |
| B. | 化学反应速率的关系为2V正(NH3)=3V正(H2O) | |
| C. | 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
11.下列有关电解的说法正确的有( )
| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
1.用石墨作电极,电解1mol•L-1下列物质的溶液,则电解前后溶液的pH保持不变的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
5.下列说法正确的是( )
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
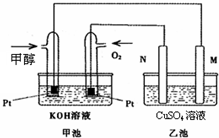 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出以甲醇为燃料的燃料电池.已知图甲池为甲醇燃
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出以甲醇为燃料的燃料电池.已知图甲池为甲醇燃
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.