题目内容
16.在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,溶液中各离子物质的量浓度由大到小的顺序正确的是( )| A. | c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | B. | c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | ||
| C. | c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | D. | c(Cl-)>c(Na+)>c(HCO3-)>c(CO32-) |
分析 在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,n(Na2CO3)=0.010L×0.1mol/L=0.001mol,n(NaOH)=)=0.010L×0.1mol/L=0.001mol,n(HCl)=0.016L×0.1mol/L=0.0016mol,
NaOH+HCl=NaCl+H2O,
0.001mol 0.001mol 0.001mol
Na2CO3+HCl=NaHCO3+NaCl,
0.0006mol 0.0006mol 0.0006mol 0.0006mol
剩余0.0004mol Na2CO3,
不发生反应NaHCO3+HCl=NaCl+CO2+H2O,
最后溶液中为0.0016molNaCl,0.0006molNaHCO3,0.0004mol Na2CO3,
据此分析溶液中各离子物质的量浓度由大到小.
解答 解;在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,n(Na2CO3)=0.010L×0.1mol/L=0.001mol,n(NaOH)=)=0.010L×0.1mol/L=0.001mol,n(HCl)=0.016L×0.1mol/L=0.0016mol,
NaOH+HCl=NaCl+H2O,
0.001mol 0.001mol 0.001mol
Na2CO3+HCl=NaHCO3+NaCl,
0.0006mol 0.0006mol 0.0006mol 0.0006mol
剩余0.0004mol Na2CO3,
不发生反应NaHCO3+HCl=NaCl+CO2+H2O,
最后溶液中为0.0016molNaCl,0.0006molNaHCO3,0.0004mol Na2CO3,
溶液中各离子物质的量浓度由大到小为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-),
故选C.
点评 本题考查了化学方程式定量计算、反应后溶液中溶质物质的量的计算应用、离子浓度大小比较等,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol | |
| B. | 达到化学平衡状态时,X、Y、Z的浓度不再发生变化 | |
| C. | 达到化学平衡状态时,反应放出的总热量可达a kJ | |
| D. | 升高反应温度,逆反应速率增大,正反应速率减小 |
| A. | 碘和苯 | B. | 乙醇和水 | C. | 苯和CCl4 | D. | 汽油和水 |
| A. | 75mL2mol•L-1 CaCl2溶液 | B. | 150mL2mol•L-1NaCl溶液 | ||
| C. | 150mL2mol•L-1KClO3溶液 | D. | 75mL1mol•L-1 AlCl3溶液 |
| A. | 把相同大小的Al和Mg分别投入相同浓度的NaOH溶液中:Al溶解有气泡放出,而Mg没有任何变化.由此得出:Al的金属性比镁强 | |
| B. | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落.由此得出:铝不能燃烧 | |
| C. | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡.由此得出:该气体一定是氨气 | |
| D. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失.由此得出:Al(OH)3能溶于强碱溶液 |
| A. |  | B. |  | C. |  | D. |  |
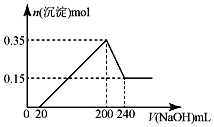 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |