题目内容
7.用分液漏斗可以分离的一组液体混合物的是( )| A. | 碘和苯 | B. | 乙醇和水 | C. | 苯和CCl4 | D. | 汽油和水 |
分析 用分液漏斗分离的一组液体,液体不能互溶,出现分层,以此来解答
解答 解:A、B、C中的液体互溶,不分层,不能用分液漏斗分离,而D中水与汽油混合分层,可用分液漏斗分离,
故选D.
点评 本题考查物质分离、提纯的方法及选择,为高频考点,把握有机物的性质及分离方法为解答的关键,侧重分液的考查,注意物质的溶解性,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
5.下列有关化学用语表示正确的是( )
| A. | 氮气的结构式:N=N | B. | F-的结构示意图: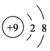 | ||
| C. | 中子数为20 的氯原子:2017Cl | D. | NH3 的电子式: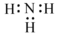 |
6.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
15.CO是一种重要的含碳化合物,它与生产、生活息息相关.
(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,此时v正< V逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

2.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
19.下列有关说法正确的是( )
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |
16.在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,溶液中各离子物质的量浓度由大到小的顺序正确的是( )
| A. | c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | B. | c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | ||
| C. | c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | D. | c(Cl-)>c(Na+)>c(HCO3-)>c(CO32-) |