题目内容
5.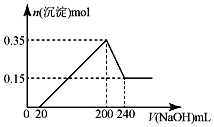 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
分析 由图可知,0~20mL发生H++OH-=H2O;20mL~200mL生成Mg(OH)2和Al(OH)3,200mL~240mL发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及守恒法计算.
解答 解:A.200mL~240mL发生Al(OH)3+OH-=AlO2-+2H2O,n[Al(OH)3]=0.35mol-0.15mol=0.2mol,则NaOH溶液的物质的量浓度为$\frac{0.2mol}{0.04L}$=5mol•L-1,故A错误;
B.200mL时沉淀质量最大,溶质为NaCl,由原子守恒可知,n(HCl)=n(NaCl)=n(NaOH)=5mol/L×0.2L=1mol,盐酸的物质的量浓度为$\frac{1mol}{0.1L}$=10mol•L-1,故B错误;
C.由Mg、Al原子守恒可知,0.15mol×24g/mol+0.2mol×27g/mol=9g,故C正确;
D.由电子守恒可知生成氢气为$\frac{0.15mol×(2-0)+0.2mol×(3-0)}{2×(1-0)}$×22.4L/mol=10.08L,故D错误;
故选C.
点评 本题考查化学反应的计算,为高频考点,把握图象与反应的对应关系、物质的量相关计算、守恒法为解答的关键,侧重分析与计算能力的考查,注意原子守恒及电子守恒的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.CO是一种重要的含碳化合物,它与生产、生活息息相关.
(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,此时v正< V逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

16.在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,溶液中各离子物质的量浓度由大到小的顺序正确的是( )
| A. | c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | B. | c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | ||
| C. | c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | D. | c(Cl-)>c(Na+)>c(HCO3-)>c(CO32-) |
13.下列对于分子式为C4H8O2的有机物X的判断正确的是( )
| A. | 能发生银镜反应且与单质钠产生气体的同分异构体有3种 | |
| B. | 能水解的X有4种同分异构体,能与NaHCO3反应的X有3种同分异构体 | |
| C. | X的某种同分异构体水解后的一种产物可以通过两步连续氧化得到另一水解产物 | |
| D. | X分子中不可能含有两个羟基 |
10.电解质在溶液中的行为是化学研究的重要内容.下列有关溶液的叙述正确的是( )
| A. | 等浓度的 CH3COOH 与 KOH 任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为 0.1 mol/L 的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 常温下 pH 为 5 的盐酸溶液稀释 1000 倍后,pH 等于 8 |
14.在100mL0.3moL•L-1的A1Cl3溶液中,加入2.3g钠块,待其充分反应后,若忽略溶液体积的变化,下列说法正确的是( )
| A. | 反应后溶液为澄清状态 | |
| B. | 反应后溶液中AlO2-浓度为0.1 mo L•L-1 | |
| C. | 反应后溶液中离子浓度最大的是Cl- | |
| D. | 溶液中Al3+与AlO2-浓度之比为2:1 |
15.用价层电子对互斥理论(VSEPR)预测H2S和NF3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |