题目内容
4.下列溶液中的Cl-浓度与50ml1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )| A. | 75mL2mol•L-1 CaCl2溶液 | B. | 150mL2mol•L-1NaCl溶液 | ||
| C. | 150mL2mol•L-1KClO3溶液 | D. | 75mL1mol•L-1 AlCl3溶液 |
分析 根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,如50mL 1mol•L-1 MgCl2溶液中氯离子浓度为c(Cl-)=1mol/L×2=2mol/L.
解答 解:50mL 1mol•L-1 MgCl2溶液中的Cl-的物质的量浓度为:c(Cl-)=2c(MgCl2)=2mol•L-1,
A.75mL2mol•L-1 CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=4mol•L-1,故A错误;
B.150mL2mol•L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=2mol•L-1,故B正确;
C.KClO3溶液中不含氯离子,故C错误;
D.75mL1mol•L-1 AlCl3溶液中Cl-的物质的量浓度为:c(Cl-)=3c(AlCl3)=3mol•L-1,故D错误;
故选B.
点评 本题考查物质的量浓度的计算,把握物质的构成、离子浓度的计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的易错点,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
2.含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如表一:
表一:
则该反应的△H=+1268KJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
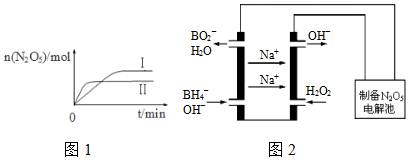
②下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图2.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.上表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
表二:
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ:2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2(g)?2ClNO(g) K2
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡.测得10min内v(ClNO)=7.5×10-3mol/(L•min),则平衡时NO的转化率α1=75%;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2>α1(填“>”“<”或“=”)
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如表一:
表一:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.

②下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图2.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.上表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
表二:
| .01mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
Ⅰ:2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2(g)?2ClNO(g) K2
①4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡.测得10min内v(ClNO)=7.5×10-3mol/(L•min),则平衡时NO的转化率α1=75%;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2>α1(填“>”“<”或“=”)
15.CO是一种重要的含碳化合物,它与生产、生活息息相关.
(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
②相同温度下,若向2L恒容密闭容器中充入1mol CO、4mol H20(g)、2mol C02、2mol H2,此时v正< V逆.(填“>”、或“<”)
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

19.下列有关说法正确的是( )
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |
16.在10mL浓度均为0.1mol/L的碳酸钠和氢氧化钠的混合溶液中逐滴加入16mL0.1mol/L的盐酸后,溶液中各离子物质的量浓度由大到小的顺序正确的是( )
| A. | c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | B. | c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | ||
| C. | c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | D. | c(Cl-)>c(Na+)>c(HCO3-)>c(CO32-) |
13.下列对于分子式为C4H8O2的有机物X的判断正确的是( )
| A. | 能发生银镜反应且与单质钠产生气体的同分异构体有3种 | |
| B. | 能水解的X有4种同分异构体,能与NaHCO3反应的X有3种同分异构体 | |
| C. | X的某种同分异构体水解后的一种产物可以通过两步连续氧化得到另一水解产物 | |
| D. | X分子中不可能含有两个羟基 |
14.在100mL0.3moL•L-1的A1Cl3溶液中,加入2.3g钠块,待其充分反应后,若忽略溶液体积的变化,下列说法正确的是( )
| A. | 反应后溶液为澄清状态 | |
| B. | 反应后溶液中AlO2-浓度为0.1 mo L•L-1 | |
| C. | 反应后溶液中离子浓度最大的是Cl- | |
| D. | 溶液中Al3+与AlO2-浓度之比为2:1 |