题目内容
9. 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
分析 (1)根据盖斯定律:由①CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-890.3kJ/mol、②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1453.0 kJ•mol-1和③H2O(l)=H2O(g)△H=+44.0kJ/mol可计算出△H1;又根据反应的焓变=反应物总键能-生成物总键能计算出△H3;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;根据勒夏特列原理分析;反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断;
(3)按平衡的三段式可求出用H2表示反应②的速率和可逆反应③的平衡常数K3;再求出浓度商跟平衡常数比较可分析出反应③v(正)与v(逆)的大小.
解答 解:(1)甲烷燃烧的热化学方程式为:①CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-890.3kJ/mol;
二甲醚燃烧的热化学方程式为:②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1453.0 kJ•mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ/mol;
对应反应2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=①×2-②+③=-890.3kJ/mol×2+1453.0kJ/mol+44.0kJ/mol=-283.6kJ•mol-1;
反应的焓变=反应物总键能-生成物总键能,而反应2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3=2×(3×413kJ/mol+343kJ/mol+453kJ/mol)-6×413kJ/mol-2×343kJ/mol-2×465kJ/mol=-24kJ/mol;
故答案为:-283.6kJ•mol-1;-24kJ•mol-1;
(2)该反应的化学平衡常数表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
升温,反应①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1,向逆反应方向移动,能正确反映反应①中CH4的体积分数随温度变化的曲线是b;
表明反应①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)达到化学平衡状态的
a.混合气体的密度始终不变,故a错误;
b.反应容器中二甲醚的百分含量不变,表明达到平衡,故b正确;
c.反应物的反应速率与生成物的反应速率之比始终等于化学计量数之比;故c错误;
d.混合气体的压强不变,表明达到平衡,故d正确.
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;b;bd;
(3)CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
转化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
v(H2)=$\frac{1.6mol/L}{8min}$=0.2mol/(L•min);
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L) 0.8 0 0
转化量(mol/L) 0.6 0.3 0.3
平衡量(mol/L) 0.2 0.3 0.3
k=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.3×0.3}{0.{2}^{2}}$=2.25;
若在500K时,容器中n(CH3OH)=n(CH3OCH3)时,设c(CH3OH)=xmol/L,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
在500K时,容器中(mol/L) x x x
浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆)
故答案为:0.2mol/(L•min);2.25;>;浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
点评 本题考查较为综合,涉及反应热与焓变、化学平衡状态的判断等知识,题目难度中等,明确化学平衡状态的特征为解答关键,注意掌握反应热与焓变的关系及应用方法,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 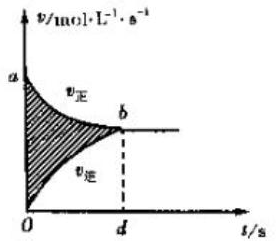 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 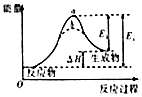 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 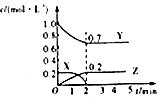 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
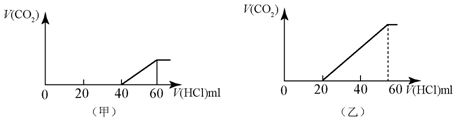
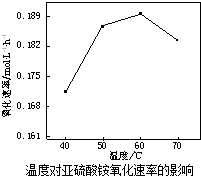 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: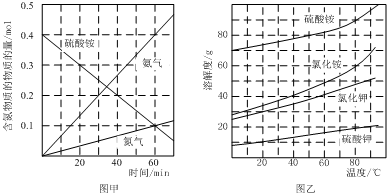
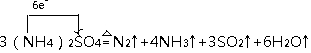 .
.
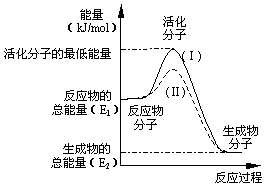 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题: