题目内容
1.(1)25℃时,M(OH)2的Ksp=4.0×10-12,求饱和溶液中的c(H+)5×10-11mol/L.(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是Fe2O3.
(3)830K时,已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g).若起始时c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,则平衡时c(H2)为1.2mol/L;K值为1.
分析 (1)可根据Ksp[M(OH)2]=c(M2+)×c2(OH-)计算c(OH-),再根据水的离子积计算溶液中氢离子浓度;
(2)将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解;
(3)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,再根据K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$计算平衡常数.
解答 解:(1)M(OH)2饱和溶液中c(M2+)=$\frac{1}{2}$c(OH-),则Ksp[M(OH)2]=c(M2+)×c2(OH-)=$\frac{1}{2}$c3(OH-),可知:c(OH-)=$\root{3}{2×4.0×1{0}^{-12}}$mol/L=2×10-4mol/L,则该溶液中c(H+)=$\frac{1×1{0}^{-14}}{2×1{0}^{-4}}$mol/L=5×10-11 mol/L,
故答案为:5×10-11 mol/L;
(2)将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,
故答案为:Fe2O3 ;
(3)起始时c(CO)=2mol/L,平衡时CO的转化率为60%,则CO转化的浓度为:2mol/L×60%=1.2mol/L,
CO+H2O(g)?CO2 +H2,
起始(mol/L) 2 3 0 0
转化(mol/L)1.2 1.2 1.2 1.2
平衡(mol/L)0.8L 1.8 1.2 1.2
平衡时氢气浓度为1.2mol/L;
该温度下该反应的平衡常数为:K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{1.2×1.2}{0.8×1.8}$=1,
故答案为:1.2 mol/L;1.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数计算、盐的水解原理、难溶物溶解平衡等知识,明确三段式在化学平衡计算中的应用为解答关键,试题培养了学生的分析能力及化学计算能力.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 明矾在水中形成的AI(OH)3胶体能吸收水中悬浮物,可用于水的净化 | |
| B. | Sio2是良好的半导体材料,常用于制造计算机的芯片 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | 浓硫酸在常温下可用铁制容器保存 |
| A. | 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA | |
| B. | 7.8gNa2O2与足量的CO2反应时转移的电子数为0.2NA | |
| C. | 1L 1 mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
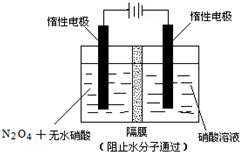 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.(填>、<或=)
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
| A. | Ba2+、Na+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、SO42- | ||
| C. | NH4+、K+、Cl-、OH- | D. | K+、H+、SO32-、ClO- |
| A. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| B. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量NaOH:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| A. | 只须验证它完全燃烧后产物只有H2O和CO2 | |
| B. | 只须测定其燃烧产物中H2O 和CO2 物质的量的比值 | |
| C. | 测定完全燃烧时消耗有机物与生成的H2O、CO2 的物质的量之比 | |
| D. | 测定该试样的质量及试样完全燃烧后生成H2O 和CO2 的质量 |
| A. | 与该反应的压强有关 | |
| B. | 与反应的温度有关,还与反应本身有关 | |
| C. | 与化学反应本身和温度有关,并且会受到起始浓度的影响 | |
| D. | 只与化学反应本身有关,与其他任何条件无关的一个不变的常数 |