题目内容
19.有关下列图象说法错误的是( )| A. | 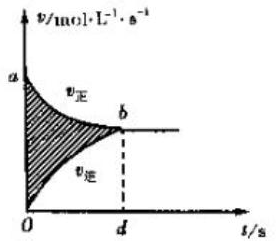 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 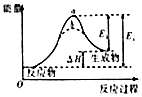 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 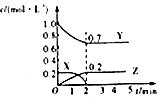 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
分析 A、图中阴影部分面积等于v正•t-v逆•t=减少反应物的物质的量浓度-增加反应物的物质的量浓度,所以等于反应物的物质的量浓度减少量;
B、图象中虚线b活化能减小,所以虚线b使用了催化剂;
C、可逆反应是反应物和生成物共存的体系;
D、曲线I变为曲线II平衡时一氧化碳的浓度不变,但达平衡的时间缩短,说明使用催化剂,由曲线I变为曲线III瞬间一氧化碳的浓度为原来的1.5倍,所以体积变为原来的$\frac{2}{3}$.
解答 解:A、图中阴影部分面积等于v正•t-v逆•t=减少反应物的物质的量浓度-增加反应物的物质的量浓度,所以图阴影部分面积表示反应物浓度的净减少量M,故A正确;B、图象中虚线b活化能减小,所以虚线b使用了催化剂,故B正确;
C、可逆反应是反应物和生成物共存的体系,所以达平衡状态时X的物质的量不可能为零,故C错误;
D、曲线I变为曲线II平衡时一氧化碳的浓度不变,但达平衡的时间缩短,说明使用催化剂,由曲线I变为曲线III瞬间一氧化碳的浓度为原来的1.5倍,所以体积变为原来的$\frac{2}{3}$,则将容器的体积快速压缩为原来的$\frac{2}{3}$,故D正确;
故选C.
点评 本题考查化学平衡与反应的能量问题,题目较为综合,难度较大,本题注意D,题目较为模糊,为易错点.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
10.下列有机物的系统命名正确的是( )
| A. |  1,2,5-三甲苯 1,2,5-三甲苯 | B. |  2-甲基-3-丁烷 2-甲基-3-丁烷 | ||
| C. |  2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | D. |  2-甲基-3-乙基丁烷 2-甲基-3-乙基丁烷 |
14.一定温度下,可逆反应H2(g)+I2(g)?2HI(g)达到化学平衡状态的标志是( )
| A. | 混合气体的颜色不再变化 | B. | 混合气体的压强不再变化 | ||
| C. | 反应速率v(H2)=$\frac{1}{2}$v(HI) | D. | c(H2):c(I2):c(HI)=1:1:2 |
4.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol铁与足量的氯气完全反应转移的电子数为2NA | |
| B. | 常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA | |
| C. | 标准状况下,1molCO2、CO的混合气中含有的碳原子数为NA | |
| D. | 1L1mol•L-1CuCl2溶液中含有的氯离子数为NA |
11.化学在生产和日常生活中有着重的应用.下列说法不正确的是( )
| A. | 明矾在水中形成的AI(OH)3胶体能吸收水中悬浮物,可用于水的净化 | |
| B. | Sio2是良好的半导体材料,常用于制造计算机的芯片 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | 浓硫酸在常温下可用铁制容器保存 |
8.下列反应不适合用来制取NH3的是( )
| A. | N2和H2在一定条件下合成氨 | |
| B. | 加热NH4Cl使其分解,可以同时获得NH3和HCl | |
| C. | 加热NH4Cl和Ca(OH)2的固体混合物,获得NH3 | |
| D. | 加热浓氨水,促使其分解制得NH3 |
9. 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
则△H1=-283.6kJ•mol-1;△H3=-24kJ•mol-1
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).