题目内容
20.2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙两种溶液,在甲和乙溶液中分别逐渐加入80mL1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系.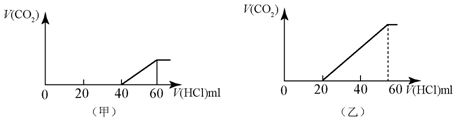
请通过计算回答以下问题:(写出必要的计算过程)
(1)甲溶液中的溶质是什么?其物质的量是多少?
(2)乙溶液中通入CO2的体积为多少?
(3)若甲、乙溶液直接混合后,得到的溶液中溶质是什么,假设混合溶液的总体积为甲、乙溶液体积之和,得到的溶液中溶质的物质的量浓度是多少?
分析 (1)(甲)中从生成CO2气体至体积达到最大消耗HCl体积为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为40mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为40mL-20mL=20mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(2)(乙)中生成CO2气体至最大,消耗HCl为40mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,根据反应生成二氧化碳时消耗盐酸体积计算出生成二氧化碳的物质的量,然后利用C原子守恒计算出乙溶液中通入CO2的体积;
(3)根据(1)(2)计算出甲、乙溶液中溶质的物质的量,然后根据碳酸氢钠、氢氧化钠的物质的量判断反应产物;最后根据c=$\frac{n}{V}$计算出混合液中溶质的物质的量浓度.
解答 解:(1)(甲)中从生成CO2气体至体积达到最大消耗HCl体积为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为40mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为40mL-20mL=20mL,
由方程式可知NaOH和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=20mL:20mL=1:1,
答:甲溶液中溶质为NaOH、Na2CO3;NaOH、Na2CO3的物质的量之比为1:1;
(2)(乙)中生成CO2气体至最大,消耗HCl为40mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,
从20mL~60mL消耗40mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为:0.04L×1mol/L=0.04mol,根据碳原子守恒,乙溶液中通入二氧化碳的物质的量为0.04mol,标准状况下该二氧化碳的体积为:0.04mol×22.4L/mol=0.896L=896mL,
答:乙溶液中通入二氧化碳气体在标准状况下的体积为896mL;
(3)根据(1)可知,甲溶液中含有NaOH、Na2CO3的物质的量为:n(NaOH)=n(Na2CO3)=1mol/L×0.02L=0.02mol;
根据(2)可知,乙溶液中含有碳酸钠的物质的量为:1mol/L×0.02L=0.02mol,根据C原子守恒可知含有NaHCO3的物质的量为:0.04mol-0.02mol=0.02mol,
若甲、乙溶液直接混合,0.02molNaOH恰好与0.02molNaHCO3反应生成0.02molNa2CO3,
所以反应后溶质为Na2CO3,总物质的量为:0.02mol+0.02mol+0.02mol=0.06mol,
混合液中碳酸钠的浓度为:c(Na2CO3)=$\frac{0.06mol}{0.05L+0.05L}$=0.6mol/L,
答:若甲、乙溶液直接混合后,得到的溶液中溶质是Na2CO3,假设混合溶液的总体积为甲、乙溶液体积之和,得到的溶液中溶质的物质的量浓度是0.6mol/L.
点评 本题考查了化学方程式的计算,题目难度中等,根据图象正确判断反应产物为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. |  1,2,5-三甲苯 1,2,5-三甲苯 | B. |  2-甲基-3-丁烷 2-甲基-3-丁烷 | ||
| C. |  2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | D. |  2-甲基-3-乙基丁烷 2-甲基-3-乙基丁烷 |
| A. | 明矾在水中形成的AI(OH)3胶体能吸收水中悬浮物,可用于水的净化 | |
| B. | Sio2是良好的半导体材料,常用于制造计算机的芯片 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | 浓硫酸在常温下可用铁制容器保存 |
| A. | N2和H2在一定条件下合成氨 | |
| B. | 加热NH4Cl使其分解,可以同时获得NH3和HCl | |
| C. | 加热NH4Cl和Ca(OH)2的固体混合物,获得NH3 | |
| D. | 加热浓氨水,促使其分解制得NH3 |
| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
| A. | 滴加KSCN溶液 | B. | 先加硝酸根,再加硝酸酸化 | ||
| C. | 利用焰色反应 | D. | 先加盐酸酸化,再加氯化钡 |
| A. | 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA | |
| B. | 7.8gNa2O2与足量的CO2反应时转移的电子数为0.2NA | |
| C. | 1L 1 mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
| A. | 只须验证它完全燃烧后产物只有H2O和CO2 | |
| B. | 只须测定其燃烧产物中H2O 和CO2 物质的量的比值 | |
| C. | 测定完全燃烧时消耗有机物与生成的H2O、CO2 的物质的量之比 | |
| D. | 测定该试样的质量及试样完全燃烧后生成H2O 和CO2 的质量 |