题目内容
18.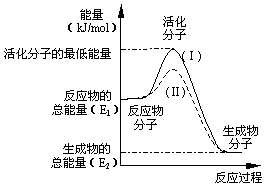 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:(1)图中所示反应是放热 (填“吸热”或“放热”)反应,该反应的△H=(E2-E1)kJ/mol(用含E1、E2的代数式表示)
(2)对于同一反应,图中虚线 (Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是使用催化剂
(3)已知热化学方程式:N2 (g)+3H2 (g)?2NH3 (g)△H=-akJ•mol-1.该反应的活化能为b kJ•mol-1,则其逆反应的活化能为(a+b)kJ/mol.
分析 (1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)催化剂可降低反应的活化能;
(3)反应热为正逆反应的活化能之差.
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量,即△H=(E2-E1)kJ•mol-1,
故答案为:放热;(E2-E1)kJ/mol;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,故答案为:使用催化剂;
(3)反应热为正逆反应的活化能之差,已知热化学方程式:N2 (g)+3H2 (g)?2NH3 (g)△H=-akJ•mol-1.该反应的活化能为b kJ•mol-1,则其逆反应的活化能为(a+b) kJ/mol,故答案为:(a+b) kJ/mol.
点评 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,为高频考点,侧重于学生的分析能力的考查,读懂图象,焓变和活化能计算方法的理解是解题的关键.

练习册系列答案
相关题目
8.下列反应不适合用来制取NH3的是( )
| A. | N2和H2在一定条件下合成氨 | |
| B. | 加热NH4Cl使其分解,可以同时获得NH3和HCl | |
| C. | 加热NH4Cl和Ca(OH)2的固体混合物,获得NH3 | |
| D. | 加热浓氨水,促使其分解制得NH3 |
9. 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
则△H1=-283.6kJ•mol-1;△H3=-24kJ•mol-1
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ•mol-1、1453.0kJ•mol-1;1mol液态水变为气态水要吸收44.0kJ的热量.反应③中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
(2)反应①的化学平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$.
制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理II,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,用H2表示反应②的速率是0.2mol/(L•min);可逆反应③的平衡常数K3=2.25.
若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)>v(逆),说明原因浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
6.下列各组中的离子能大量共存的是( )
| A. | Ba2+、Na+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、SO42- | ||
| C. | NH4+、K+、Cl-、OH- | D. | K+、H+、SO32-、ClO- |
13.下列离子方程式中正确的是( )
| A. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| B. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量NaOH:Ca2++OH-+HCO3-═CaCO3↓+H2O |
10.验证某有机物属于烃的含氧衍生物,应完成的实验内容是( )
| A. | 只须验证它完全燃烧后产物只有H2O和CO2 | |
| B. | 只须测定其燃烧产物中H2O 和CO2 物质的量的比值 | |
| C. | 测定完全燃烧时消耗有机物与生成的H2O、CO2 的物质的量之比 | |
| D. | 测定该试样的质量及试样完全燃烧后生成H2O 和CO2 的质量 |
7.对仪器的使用和操作,下列说法正确的是( )
| A. | 容量瓶在使用前一定要检漏、洗涤并烘干 | |
| B. | 使用胶头滴管时,特殊情况下也可把滴管插入到溶液中 | |
| C. | 萃取过程中,不需要打开分液漏斗的玻璃塞,以防止其漏气 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
8.2,3,4三甲基戊烷与氯气发生取代反应时,生成的一氯化物有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
