题目内容
7.工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可架用如图工艺流程: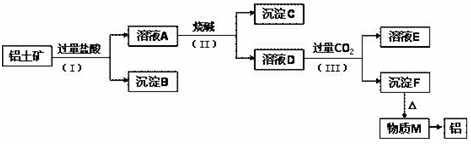
已知:SiO2不溶于水且不与盐酸反应.
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是过滤(填操作名称).
(2)步骤(Ⅱ)中加入的烧碱溶液应该是过量(填“少量”或“过量”).沉淀B的成分是SiO2(填化学式,下同);溶液D中含铝元素的溶质的是NaAlO2(或AlO2-).
(3)①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
②溶液D中通入过量CO2生成沉淀F的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 由流程可知,铝土矿加过量盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解发生MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O、Al2O3+6HCl=2AlCl3+3H2O,而SiO2不与盐酸反应,可知沉淀B为SiO2;
滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,则沉淀C的成分是Mg(OH)2、Fe(OH)3;
氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,可知溶液D中大量存在的阴离子是AlO2-、Cl-、OH-,D与过量二氧化碳反应生成Al(OH)3、NaHCO3,E为碳酸氢钠,沉淀F为Al(OH)3,加热生成M为Al2O3,电解Al2O3生成Al,以此来解答.
解答 解:(1)分离溶液与沉淀的实验方法是过滤,故答案为:过滤;
(2)由上述分析可知,步骤(Ⅱ)中加入的烧碱溶液应该是过量,分离出铝离子;沉淀B的成分是SiO2,溶液D中含铝元素的溶质的是NaAlO2(或AlO2-),
故答案为:过量;SiO2;NaAlO2(或AlO2-);
(3)①沉淀F转化为物质M的化学方程式2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,故答案为:2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
②溶液D中通入过量CO2生成沉淀F的离子方程式为 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| 阳离子 | K+、Cu2+、Fe3+、Ca2+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
下列推断不正确的是( )
| A. | 溶液中一定含有的离子是K+、Cl-、CO32-、NO3-、SO42- | |
| B. | Ⅰ中加入盐酸生成无色气体的离子方程式是CO32-+2H+═CO2↑+H2O | |
| C. | 原溶液中的K+、Cl-、NO3-存在与否无法确定 | |
| D. | Ⅱ中产生白色沉淀的离子方程式是Ba2++SO42-═BaSO4↓ |
| A. | 质子数:d>c>b>a | B. | 离子半径:W2+>X+>Y2->Z- | ||
| C. | 原子半径:Z<Y<W<X | D. | 最低负价:X<W<Z<Y |
| 实验序号 | I | II | III |
| 盐酸体积(mL) | 50.0 | 50.0 | 50.0 |
| 样品质量/g | 9.2 | 15.7 | 27.6 |
| CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
(2)第III组实验后,剰余NaHCO3的物质的量为0.075mol.
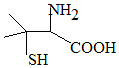 靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )
靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | X的分子式为C5H10NO2S | |
| C. | X只能发生取代反应 | |
| D. | X中碳原子上的H若有1个被Cl取代,有2种不同产物 |
| A. | KClO3→KCI | B. | HNO3→NO | C. | Mn2+→Mn04- | D. | Fe3+→Fe2+ |