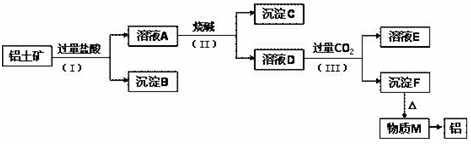
题目内容
16.某工业废水中仅含下表离子中的5种:| 阳离子 | K+、Cu2+、Fe3+、Ca2+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
下列推断不正确的是( )
| A. | 溶液中一定含有的离子是K+、Cl-、CO32-、NO3-、SO42- | |
| B. | Ⅰ中加入盐酸生成无色气体的离子方程式是CO32-+2H+═CO2↑+H2O | |
| C. | 原溶液中的K+、Cl-、NO3-存在与否无法确定 | |
| D. | Ⅱ中产生白色沉淀的离子方程式是Ba2++SO42-═BaSO4↓ |
分析 Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体,气体为二氧化碳,则一定含CO32-,阴离子一定不含SiO32-,阳离子一定不含Cu2+、Fe3+、Ca2+、Fe2+;
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,因I中盐酸足量,白色沉淀可能为硫酸钡,则原溶液中一定含SO42-,以此来解答.
解答 解:由上述分析可知,一定含CO32-、SO42-,由电荷守恒可知,阳离子一定含K+,溶液中不含Cu2+、Fe3+、Ca2+、Fe2+、SiO32-,不能确定是否含Cl-、NO3-,
A.因溶液含5种离子,则含有的离子是K+、Cl-、CO32-、NO3-、SO42-,故A正确;
B.Ⅰ中加入盐酸生成无色气体为二氧化碳,离子方程式是CO32-+2H+═CO2↑+H2O,故B正确;
C.由选项A可知,一定含K+、Cl-、NO3-,故C错误;
D.Ⅱ中产生白色沉淀为硫酸钡,离子方程式是Ba2++SO42-═BaSO4↓,故D正确;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、离子共存、电荷守恒为解答的关键,侧重分析与推断能力的考查,注意含5种离子的限制条件,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
7.下列有关实验原理或实验操作正确的是( )
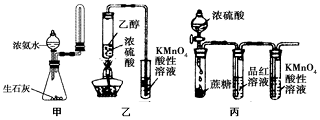

| A. | 实验室用图甲所示装置制取少量氨气 | |
| B. | 为使100ml0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50ml水 | |
| C. | 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 | |
| D. | 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
4.下列说法不正确的是( )
| A. | 等物质的量的乙烯和乙醇完全燃烧消耗氧气的量相等 | |
| B. | 戊烷和2-甲基丁烷是同系物 | |
| C. | 甲烷的二氯代物只有一种的事实,可证明甲烷为正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
11.下列事实不能说明CH3COOH位弱酸的是( )
| A. | 测得0.10mol/LCH3COOH溶液中存在较多的CH3COOH分子 | |
| B. | 比较等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成H2的体积 | |
| C. | 比较等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量 | |
| D. | 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性 |
1.化学在日常生活中应用广泛,下列叙述及对应关系错误的是( )
| 实际应用 | 相应性质 | |
| A | 用含有酸性重铬酸钾溶液的仪器检验酒后驾车 | 乙醇具有还原性 |
| B | 明矾常用于自来水的净化、杀菌消毒 | 明矾可发生水解生成胶状的Al(OH)3 |
| C | BaSO4可作为造影剂检查肠胃道疾病 | BaSO4难溶于水且不与盐酸反应 |
| D | 过氧化钠可用作呼吸面具中的供氧剂 | Na2O2能与CO2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证Cl2的氧化性强于I2 | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,可观察到溶液变成蓝色 |
| B | 配制100mL 1.0mol•L-1CuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| C | 比较水与乙醇中氢的活泼性 | 分別将少量钠投入到盛有水和乙醇的烧杯中 |
| D | 验证Cu(OH)2的溶解度小于Mg(OH)2 | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液,可观察到先有白色沉淀生成,后变为浅蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
5.下列关于有机物的叙述正确的是( )
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 氯苯分子中所有原子都处于同一平面 | |
| D. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 |
 ;
;