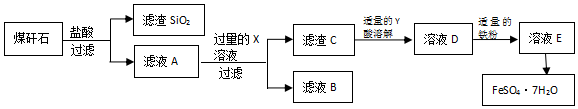
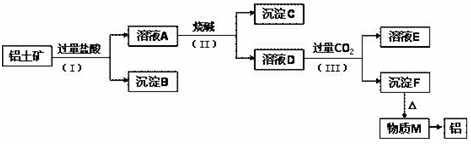
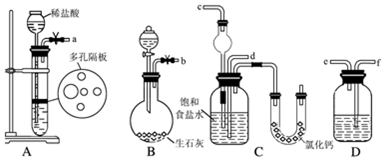
题目内容
15.工业食盐含Ca2+、Mg2+、SO42-等杂质,要想精炼成精盐,请回答下列问题:(1)除去SO42-,必须添加钡试剂,该钡试剂可以是AB
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(2)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为BC.
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3.
分析 (1)选择氯化钡或Ba(OH)2除去SO42-,但B中引入新杂质硝酸根离子;
(2)除去Ca2+、Mg2+、SO42-,选碳酸钠除去钙离子,选氢氧化钠除去镁离子,选氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后可除去过量的钡离子,以此来解答.
解答 解:(1)除去SO42-,必须添加钡试剂,该钡试剂可以是Ba(OH)2、BaCl2,不能选Ba(NO3)2,引入新杂质硝酸根离子不能除去,故答案为:AB;
(2)为了有效除去Ca2+、Mg2+、SO42-,选碳酸钠除去钙离子,选氢氧化钠除去镁离子,选氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后可除去过量的钡离子,则BC均可以,故答案为:BC.
点评 本题考查粗盐提纯,为高频考点,把握除杂试剂的选择、先后顺序及除杂原则为解答的关键,侧重分析与实验能力的考查,注意碳酸钠在氯化钡之后,题目难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
4.下列说法不正确的是( )
| A. | 等物质的量的乙烯和乙醇完全燃烧消耗氧气的量相等 | |
| B. | 戊烷和2-甲基丁烷是同系物 | |
| C. | 甲烷的二氯代物只有一种的事实,可证明甲烷为正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
5.下列关于有机物的叙述正确的是( )
| A. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| B. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 氯苯分子中所有原子都处于同一平面 | |
| D. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 |
3.某非金属单质气体Y2在加热条件下,1mol Y2 (g)与80克烧碱恰好完全反应,生成NaY、H2O和另一种气体,该气体是下列中的( )
| A. | H2 | B. | HY | C. | Y2 O | D. | O2 |
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到l.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5种离子 | |
| B. | C1-一定存在,且c Cl-)≥0.4mol/L | |
| C. | SO42-、NH4+一定存在,CO32-可能存在 | |
| D. | CO32-、Al3+一定不存在,K+一定存在 |