题目内容
13.下列叙述不正确的是( )| A. | 与电源正极相连的电极上发生还原反应 | |
| B. | 与电源负极相连的电极称为电解池的阴极 | |
| C. | 电解熔融氯化钠时,阳极上析出Cl2 | |
| D. | 电解是电能转化为化学能的过程 |
分析 电解是电能转化为化学能的过程,电解池的阴极连接电源的负极,发生还原反应,电解池的阳极连接电源的正极,发生氧化反应,以此解答该题.
解答 解:A.与直流电源正极相连的是电解池的阳极,阳极发生氧化反应,故A错误;
B.与直流电源负极相连的电极为阴极,发生还原反应,故B正确;
C.电解熔融氯化钠时,氯离子在阳极放电,失电子后产生氯气,故C正确;
D.电解是电能转化为化学能的过程,故D正确.
故选A.
点评 本题考查电解池知识,为高频考点,侧重于学生的双基的考查,解答本题需了解电解池阴、阳极的判断及电解的特点,电解池的阴、阳极是根据直流电源的正、负极确定的,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列反应中,属于取代反应的是( )
| A. | 在催化剂存在条件下乙烯与溴反应制 1,2-二溴乙烷 | |
| B. | 在一定条件下苯与氢气反应制取环己烷 | |
| C. | 甲苯使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
4.关于二氧化硫的下列说法中,不正确的是( )
| A. | SO2是硫及其某些硫化物在空气中燃烧的产物 | |
| B. | SO2具有漂白作用,也有防腐作用 | |
| C. | SO2是硫酸的酸酐,称为硫酐 | |
| D. | SO2是一种大气污染物 |
1.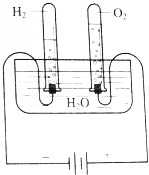 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
根据该实验的观察与推算能否初步得出下列结论:在相同温度和压强下.1molO2和H2的体积相同.
 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
| 质量g | 物质的量 | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
18.下列说法正确的是( )
| A. | 糖类在一定条件下可以水解生成乙醇和二氧化碳 | |
| B. | 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性 |
5.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.H与G同主族,且比G多2个电子层.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程 .
.
(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为 、
、 .
.
(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程
 .
.(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为
 、
、 .
.(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
| 实验操作 | 实验现象 |
| 取KI溶液于试管中,向其中加入少量或适量氯水 向上述溶液中加入CCl4(或加滴淀粉)振荡、静置 (或淀粉-KI溶液或淀粉-KI试纸→必须润湿) 或在淀粉-KI试纸上滴加氯水 | 分层,上层几乎无色,下层紫红色 (试纸变蓝) |

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2NaCl
+2NaCl 有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为
有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为


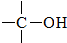 +
+ $→_{△}^{H_{2}SO_{4}(浓)}$
$→_{△}^{H_{2}SO_{4}(浓)}$ +H2O
+H2O +R′CHO$\stackrel{一定条件}{→}$
+R′CHO$\stackrel{一定条件}{→}$
 .
. .
. .
.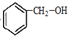 ,名称是苯甲醇.
,名称是苯甲醇. .
.
 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)