题目内容
17.高温下硫酸亚铁发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钙溶液中,得到的沉淀是( )| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
分析 混合气体中含有SO2和SO3,将生成的气体通入氯化钙溶液中发生:SO3+H2O=H2SO4,SO2+H2O=H2SO3,结合亚硫酸酸性弱于盐酸及复分解反应发生条件解答.
解答 解:混合气体中含有SO2和SO3,将生成的气体通入氯化钙溶液中发生:SO3+H2O=H2SO4,SO2+H2O=H2SO3,硫酸与氯化钙反应生成硫酸钙沉淀,亚硫酸酸性溶液盐酸,与氯化钙不反应,所以生成沉淀为硫酸钙,
故选:B.
点评 本题考查了元素化合物之间反应,明确二氧化硫、三氧化硫性质及强酸制备弱酸规律、复分解反应发生条件是解题关键,题目难度不大.

练习册系列答案
相关题目
8.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞变红色的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO32-、Ca2- | |
| C. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、HCO3- | |
| D. | 显强酸性的溶液中:Na+、SO42-、ClO-、Cl- |
5.某有机物在标准状况下其密度为1.25g•L-1,则这种有机物的分子式可能是( )
| A. | CO | B. | C2H6 | C. | CH4 | D. | C2H4 |
2.某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象.请帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:仪器:试管、胶头滴管.
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容).
(4)实验结论:同主族元素从上到下元素原子的得电子能力逐渐减弱.
(5)问题和讨论.
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-=Br2+2Cl-、2I-+Br2=2Br-+I2.
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯的强:HF的稳定性比HCl强、F2能置换出水中的氧,而Cl2不能置换出水中的氧.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:仪器:试管、胶头滴管.
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳.
(3)实验内容(在下表横线中填写相关内容).
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈紫红色 |
(5)问题和讨论.
①上述两个实验中发生反应的离子方程式分别为Cl2+2Br-=Br2+2Cl-、2I-+Br2=2Br-+I2.
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱.试列举两项事实说明氟的非金属性比氯的强:HF的稳定性比HCl强、F2能置换出水中的氧,而Cl2不能置换出水中的氧.
9.与Li<Na<K<Rb<Cs的变化规律不符合的是( )
| A. | 原子半径 | B. | 单质熔沸点 | ||
| C. | 与水或酸反应置换氢气的剧烈程度 | D. | 最高价氧化物对应水化物的碱性 |
 如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.
如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.
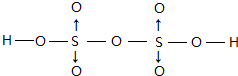 (配位键须注明).
(配位键须注明).