题目内容
5.某有机物在标准状况下其密度为1.25g•L-1,则这种有机物的分子式可能是( )| A. | CO | B. | C2H6 | C. | CH4 | D. | C2H4 |
分析 某有机物在标准状况下其密度为1.25g•L-1,有机物的摩尔质量=1.25g/L×22.4L/mol=28g/mol,故为乙烯.
解答 解:有机物的摩尔质量=1.25g/L×22.4L/mol=28g/mol,CO的摩尔质量虽然为28g/mol,但不属于有机物,故有机物不可能含有O原子,分子中最大碳原子数目=$\frac{28}{12}$=2…4,则该有机物为C2H4,
故选:D.
点评 本题考查有机物分子式的确定,难度不大,关键是计算有机物的摩尔质量,有利于基础知识的巩固.

练习册系列答案
相关题目
15.同温度下的两种稀氨水A和B,A的浓度为c mol•L-1、电离度为α1;B溶液中c(NH4+)为c mol•L-1、电离度为α2.则下列判断错误的是( )
| A. | A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍 | |
| B. | α1>α2 | |
| C. | B溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1 | |
| D. | pH:溶液A>溶液B |
16.关于化学键的叙述中,正确的是( )
| A. | HCl电离产生H+和 Cl-,可判断HCl分子中存在离子键 | |
| B. | NaHSO4固体中含有的阴离子与阳离子的个数比为1:1 | |
| C. | 化学键是指使原子或离子相互结合的静电吸引作用力 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
20.下列化合物中只含有共价键的是( )
| A. | MgCl2 | B. | KCl | C. | NH4Cl | D. | H2SO4 |
17.高温下硫酸亚铁发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钙溶液中,得到的沉淀是( )
| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
14.类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列各说法中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| B. | CH4是正四面体结构,则SiH4也是正四面体结构 | |
| C. | 锂与氧气反应:4Li+O2═2 Li2O,则钠与氧气反应:4Na+O2═2Na2O | |
| D. | CaCO3与稀硝酸反应生成CO2,则CaSO3与稀硝酸反应生成SO2 |
15.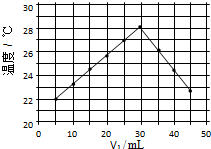 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为1.5mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
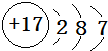
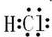 ;
;