题目内容
7.X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素.X原子2p能级有两个未成对电子,但没有空轨道.Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数.Z与X同族.P原子的基态+2价阳离子的价电子排布为3d2.Q位于第ⅠB族.根据以上信息,回答下列问题.(1)X的基态原子核外有8种不同运动状态的电子.
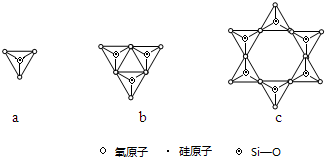
(2)Y与X可以形成多种复杂阴离子,如图所示,若其中a对应的阴离子化学式为SiO44-,则c对应的阴离子的化学式为Si6O1812-.
(3)Z能形成很多种含氧酸,如H2ZO3、H2ZO4.Z的某种含氧酸分子式为H2Z2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式
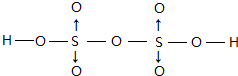 (配位键须注明).
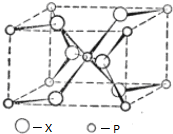
(配位键须注明).(4)P与X形成的某种晶体的晶胞结构如图所示,其晶体的化学式为TiO2,P的配位数为6.
(5)向盛有QZX4的溶液中加入氨水至过量,现象为先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液,相关反应的离子方程式为Cu2++2NH3﹒H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.NF3的空间构型是三角锥形,NF3不易与Cu2+形成配离子,其原因是NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键.
分析 X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素.X原子2p能级有两个未成对电子,但没有空轨道,原子核外电子排布为1s22s22p4,则X为O元素;Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数,则M层电子数为4,故Y为Si;P原子的基态+2价阳离子的价电子排布为3d2,则P原子外围电子排布式为3d24s2,故P为Ti;Q位于第ⅠB族,则Q为Cu;Z与X同族,Z的原子序数小于Ti,故Z为S元素.
(1)原子核外没有运动状态相同的电子;
(2)c中Si原子数目为6,O原子数目为6,计算化合价代数和确定离子所带电荷,进而确定化学式;
(3)含氧酸H2S2O7属于二元酸,其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键;
(4)根据均摊法计算晶胞中O、Ti原子数目,确定晶体的化学式;由图可知P的配位数为6;
(5)向盛有CuSO4的溶液中加入氨水至过量,先生成氢氧化铜沉淀,氨水过量时,沉淀溶解生成[Cu(NH3)4]2+;
计算NF3中N原子孤电子对、价层电子对数=3+1=4,确定空间构型;NF3分子中氟原子电负性大,非金属性强,使得氮原子上的孤电子对难于与Cu2+形成配位键.
解答 解:X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素.X原子2p能级有两个未成对电子,但没有空轨道,原子核外电子排布为1s22s22p4,则X为O元素;Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数,则M层电子数为4,故Y为Si;P原子的基态+2价阳离子的价电子排布为3d2,则P原子外围电子排布式为3d24s2,故P为Ti;Q位于第ⅠB族,则Q为Cu;Z与X同族,Z的原子序数小于Ti,故Z为S元素.
(1)X为O元素,原子核外有8个电子,则基态原子核外有8种不同运动状态的电子,
故答案为:8;
(2)a对应的阴离子化学式为SiO44-,则c中Si原子数目为6,O原子数目为6,化合价代数和为6×4+18×(-2)=-12,对应的阴离子的化学式为Si6O1812-,
故答案为:Si6O1812-;
(3)含氧酸H2S2O7属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键,其结构式为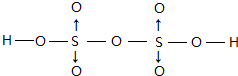 ,
,
故答案为: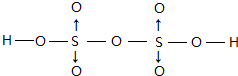 ;
;
(4)晶胞中O原子数目为2+4×$\frac{1}{2}$=4,Ti原子数目为1+8×$\frac{1}{8}$=2,故晶体的化学式为TiO2,由图可知P的配位数为6,
故答案为:TiO2;6;
(5)向盛有CuSO4的溶液中加入氨水至过量,现象为:先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液,相关反应的离子方程式为:Cu2++2NH3﹒H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
NF3中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,故其为三角锥形,NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键,
故答案为:先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液;Cu2++2NH3﹒H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;三角锥形;NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、微粒结构、晶胞结构与计算、配合物、空间构型等,(5)中注意根据电负性判断N原子孤对电子不易形成配位键.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
| A. | 生成盐类物质 | B. | 生成酸类物质 | C. | 生成酯类物质 | D. | 生成醇类物质 |
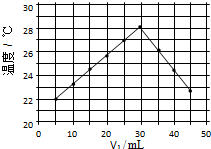 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为1.5mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
| A. | 2s轨道可以和3p轨道形成sp2杂化轨道 | |
| B. | 烯烃中的碳碳双键由l个σ键和l个π键组成 | |
| C. | 由极性键组成的分子,一定是极性分子 | |
| D. | 甲烷中sp3杂化轨道的构型是平面正方形 |
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤消去.
| A. | ①③④ | B. | ①③④⑤ | C. | ②③④ | D. | ①③⑤ |