题目内容
12. 如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.
如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.(1)该盐酸中HCl的物质的量浓度.
(2)将6.50g锌投入足量的该盐酸中,充分反应后生成的H2在标准状况下的体积.
分析 (1)依据C=$\frac{1000ρω}{M}$计算氯化氢的物质的量浓度;
(2)依据n=$\frac{m}{M}$金属锌的质量,依据Zn+2HCl=ZnCl2+H2↑计算产生氢气的体积.
解答 解:(1)依据图中所售盐酸试剂瓶标签上数据可知:氯化氢的摩尔质量为:36.5g/mol,密度为1.18g/ml,氯化氢的质量分数为36.5%,则氯化氢的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L;
答:该盐酸中HCl的物质的量浓度11.8mol/L;
(2)6.50g锌物质的量n=$\frac{6.5g}{65g/mol}$=0.1mol,盐酸足量,应依据锌的量计算氢气的物质的量,设生成标况下氢气体积为V,则:
Zn+2HCl=ZnCl2+H2↑
1 22.4L
0.1mol V
解得V=2.24L;
答:将6.50g锌投入足量的该盐酸中,充分反应后生成的H2在标准状况下的体积2.24L.
点评 本题考查物质的量浓度的计算,明确物质的量浓度与质量百分数浓度之间的换算公式,明确锌与盐酸反应的方程式即可解答,题目难度不大.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L气体氘气(D2)中含有0.5NA个中子 | |
| B. | 1 L 0.1 mol•L-1醋酸溶液中含有0.1NA个氢离子 | |
| C. | 电解精炼铜时,若电路中转移0.2NA个电子,则阳极质量一定减少6.4 g | |
| D. | NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为NA个 |
3.氯气是一种重要的工业原料.工业上利用反应3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气则遇氨就会产生白烟 | |
| B. | 该反应利用了Cl2的强氧化性 | |
| C. | 实验室可用 NH4Cl受热分解制取NH3 | |
| D. | 生成1 molN2有6 mol电子转移 |
20.下列化合物中只含有共价键的是( )
| A. | MgCl2 | B. | KCl | C. | NH4Cl | D. | H2SO4 |
7.蓝宝石的主要成分为第ⅢA族某元素的氧化物,关于该氧化物的描述正确的是( )
| A. | 该氧化物为Fe2O3 | |
| B. | 该氧化物具有较高的熔点 | |
| C. | 该氧化物易溶于水 | |
| D. | 该氧化物能与强酸反应,但不能与强碱反应 |
17.高温下硫酸亚铁发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钙溶液中,得到的沉淀是( )
| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
4.下列化学用语正确的是( )
| A. | 二氧化碳分子的比例模型 | B. | NH3的电子式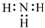 | ||
| C. | 乙烷的分子式 CH3CH3 | D. | 丙烯的结构简式 CH3CH=CH2 |
1.把a、b、c、d 4块金属浸入稀硫酸中,用导线两两相连组成原电池.若把a、b相连时,a为负极;若a、c相连时,电流由c经导线流向a; b、d相连时,电子经由导线由d流向b,则四种金属的活动顺序由强到弱的顺序是( )
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>a>c>d |