题目内容
8.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 使酚酞变红色的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO32-、Ca2- | |
| C. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、HCO3- | |
| D. | 显强酸性的溶液中:Na+、SO42-、ClO-、Cl- |
分析 A.使酚酞变红色的溶液呈碱性;
B.使紫色石蕊试纸变红色的溶液呈酸性;
C.与Al反应生成氢气的溶液为强碱或弱氧化性酸;
D.呈强酸性溶液中,离子之间不能发生反应且和氢离子之间不反应离子的能大量共存.
解答 解:A.使酚酞变红色的溶液呈碱性,这几种离子之间不反应,且和氢氧根离子不反应,所以能大量共存,故A正确;
B.使紫色石蕊试纸变红色的溶液呈酸性,酸性条件下Fe2+、NO32-发生氧化还原反应而不能大量共存,故B错误;
C.与Al反应生成氢气的溶液为强碱或弱氧化性酸,无论酸性还是碱性条件下都不能大量存在HCO3-,酸性条件下,硝酸根离子和Al反应生成NO而不是氢气,故C错误;
D.强酸性条件下,ClO-不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质、离子之间反应是解本题关键,涉及氧化还原反应、复分解反应,注意B中酸性条件下发生的氧化还原反应,为易错点.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
16.关于化学键的叙述中,正确的是( )
| A. | HCl电离产生H+和 Cl-,可判断HCl分子中存在离子键 | |
| B. | NaHSO4固体中含有的阴离子与阳离子的个数比为1:1 | |
| C. | 化学键是指使原子或离子相互结合的静电吸引作用力 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
3.氯气是一种重要的工业原料.工业上利用反应3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 若管道漏气则遇氨就会产生白烟 | |
| B. | 该反应利用了Cl2的强氧化性 | |
| C. | 实验室可用 NH4Cl受热分解制取NH3 | |
| D. | 生成1 molN2有6 mol电子转移 |
20.下列化合物中只含有共价键的是( )
| A. | MgCl2 | B. | KCl | C. | NH4Cl | D. | H2SO4 |
17.高温下硫酸亚铁发生如下反应:2FeSO4=Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钙溶液中,得到的沉淀是( )
| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
18.家庭烹饪时,同时加酒和醋,烹饪出的菜更可口,这是因为有( )
| A. | 生成盐类物质 | B. | 生成酸类物质 | C. | 生成酯类物质 | D. | 生成醇类物质 |
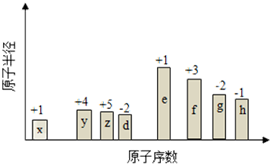 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: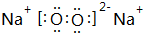 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.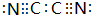 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.