题目内容
20.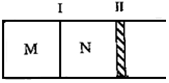 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
分析 M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量,进而表示出A的体积分数,据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、根据平衡时C的物质的量,利用三段式计算出平衡时各组分的物质的量,根据压强一定时,物质的量之比等于体积比计算.
解答 解:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y 0
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为$\frac{x-z}{x+y-2z}$,A的体积分数始终为定值,则x=y,故A正确;
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=$\frac{a}{x}$,B的转化率=$\frac{3a}{2x}$,则平衡时,M中的转化率:A<B,故B正确;
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为$\frac{172.8kJ}{192kJ}$×1mol=0.9mol,故A的转化率为$\frac{0.9}{x}$,故C错误;
D、若x=1.4,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,则:
A(g)+3B(g)?2C(g)
起始:1.4 1 0
反应:0.2 0.6 0.4
平衡:1.2 0.4 0.4
故A、B、C的平衡时的物质的量分别为1.2mol、0.4mol、0.4mol,则平衡时总物质的量为2mol,
根据压强一定时,物质的量之比等于体积比,设平衡时体积为VL,则$\frac{2.4mol}{2mol}=\frac{2L}{VL}$,所以V=$\frac{5}{3}$L,初始M、N容积相同,所以体积为$\frac{5}{3}$L,故D错误;
故选CD.
点评 本题考查化学平衡的计算、转化率的计算等,难度较大,D选项为易错点、难点,注意根据平衡常数判断平衡移动方向,A选项中注意数据的分析处理.

| A. | 植物油 | B. | 馒头 | C. | 牛肉 | D. | 橙子 |
| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母).

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),图2中的压强由大到小为P3>P2>P1.
| 化学式 | pKsp | pH | |
| 开始沉淀时 | 沉淀完全时 | ||
| Mg(OH)2 | / | 10.8 | 13.3 |
| Cu(OH)2 | / | 4.4 | / |
| Fe(OH)3 | / | 1.5 | / |
| Al(OH)3 | 33 | / | / |
| A. | Mg(OH)2不溶于pH=7的CH3COONH4溶液 | B. | PKsp[Mg(OH)2]>PKsp[Cu(OH)2] | ||
| C. | Fe(OH)3的PKsp=38.5 | D. | Al3+在溶液中沉淀完全的pH=5 |
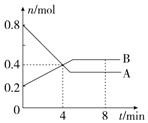 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: