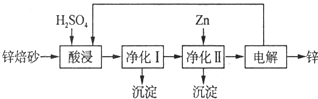
题目内容
4. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应注视锥形瓶内容液颜色变化;
(3)该小组在步骤①中的错误是锥形瓶不能用待测液润洗,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
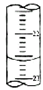
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据下列数据:
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)根据标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点颜色的变化;
(2)滴定时根据锥形瓶中溶液颜色变化来判断滴定终点;
(3)根据锥形瓶装液前不能润洗;根据根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$判断不当操作对相关物理量的影响;
(4)酸式滴定管要用标准盐酸溶液润洗;
(5)根据滴定管的结构和精确度;
(6)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度.
解答 解:(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,
故答案为:红;无;
(2)滴定时根据锥形瓶中溶液颜色变化来判断滴定终点,所以滴定时眼睛要注视锥形瓶内容液颜色变化;
故答案为:锥形瓶内容液颜色变化;
(3)锥形瓶装液前不能润洗;若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(酸)增大,根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$可知,c(碱)偏高;
故答案为:锥形瓶不能用待测液润洗;偏高;
(4)酸式滴定管用蒸馏水洗净后,要用标准盐酸溶液润洗,否则,盐酸的浓度会减小,从而产生误差;
故答案为:用标准液润洗滴定管;
(5)滴定管中的液面的读数为22.60mL,故答案为:22.60;
(6)两次消耗的盐酸标准液的体积为19.90mL,20.10mL,均有效,盐酸溶液的平均体积为$\frac{19.90mL+20.10mL}{2}$=20.00mL,
HCl~~~~~NaOH
1 1
0.1000mol•L-1×20.00 c(烧碱)×25.00
解得c(盐酸)=0.08mol/L,
故答案为:0.08.
点评 本题考查酸碱中和滴定,题目难度中等,明确中和滴定实验的仪器、步骤、终点的判定、数据处理等即可解答,注意把握误差分析的方法,侧重于考查学生的分析能力和计算能力.

(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在A(填编号字母)称量.
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol•L-1的盐酸来滴定待测溶液,不可选用B(填编号字母)作指示剂.
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视眼睛注视锥形瓶中溶液颜色变化;在铁架台上垫一张白纸,其目的是便于观察溶液颜色变化.
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1,烧碱样品的纯度是97.56%.
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果偏高.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
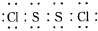 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
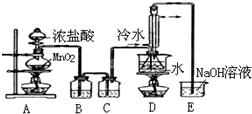
(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中ACD实验.
A.石油分馏 B.制备乙烯
C.制取乙酸乙酯 D.制取溴苯
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:A.用酸式滴定管准确移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液、待测盐酸溶液分别润洗碱式滴定管、酸式滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.就此实验完成如下填空:
(1)正确操作步骤的顺序是BDCEAF(用序号字母填写);
(2)下列可以作为本次滴定实验最佳指示剂的是C;
A.淀粉 B.石蕊 C.酚酞 D.KMnO4
(3)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色;
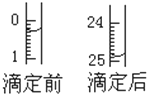
(4)如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准KOH溶液的体积填入下表空格中.有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
(6)下列几种情况会使测定结果偏高的是ac.
a.上述A步骤操作之前,先用待测液润洗锥形瓶
b.读数时,若滴定前仰视,滴定后俯视
c.若在滴定过程中不慎将数滴碱液滴在锥形瓶外
d.若未充分振荡,刚看到溶液变色,立刻停止滴定
f.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸.
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.以下是实验数据记录表:
| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)计算待测盐酸溶液浓度.
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量小,说明反应为放热反应,△H小于0.
(2)容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(3)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
| A. | 生石灰 | B. | 亚硫酸钠(Na2SO3) | C. | 铁粉 | D. | 硫酸亚铁(FeSO4) |
 ;
;