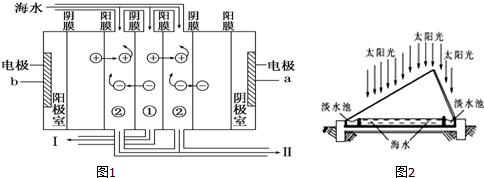
题目内容
6.通常情况下,氯化钠、氯化艳、二氧化碳和二氧化硅的晶体结构分别如图所示: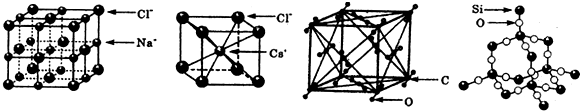
下列关于这些晶体结构和性质的叙述不正确的是( )
| A. | 干冰的晶胞中含有6个CO2分子 | |
| B. | 干冰是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| C. | 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 | |
| D. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
分析 A.利用均摊法计算CO2分子数;
B.分子晶体中,构成分子的原子之间可形成化学键;
C.二氧化硅晶体中,每个硅原子和4个氧原子形成共价键,每个氧原子和2个硅原子形成共价键;
D.二氧化硅与二氧化碳的晶体类型不同.
解答 解:A.干冰是分子晶体,CO2分子位于立方体的顶点和面心上,则每个干冰晶胞占有CO2分子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故A错误;
B.二氧化碳分子晶体中,不仅存在分子间作用力,构成分子的原子之间可形成化学键,如CO2含有C=O键,故B正确;
C.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键,故C正确;
D.碳和硅同主族,二氧化硅为原子晶体,为空间网状结构,具有较高的熔点,二氧化碳为分子晶体,熔点较低,二者晶体结构不同,故D正确;
故选A.
点评 本题主要考查了不同晶体组成、性质差异,题目难度不大,注意利用均摊法计算晶胞中各种原子个数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.已知可逆反应:N(g)+M(g)?P(g)+Q(g)△H>0,请回答下列问题:
(1)若要增大M的转化率,在其他条件不变的情况下可以采取的措施为BC(填字母).
A.加入一定量M B.加入一定量N
C.将生成的气体P液化分离
D.缩小反应容器的体积
(2)不同温度下该反应的平衡常数如下:则K1< (填“>”或“<”)K2.
(3)某温度下,反应物的起始浓度[M]=1.0mol•L-1,[N]=2.4mol•L-1,达到平衡后,M的转化率为60%,此时N的转化率为25%,该反应的平衡常数Kc=0.5.
(1)若要增大M的转化率,在其他条件不变的情况下可以采取的措施为BC(填字母).
A.加入一定量M B.加入一定量N
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
D.缩小反应容器的体积
(2)不同温度下该反应的平衡常数如下:则K1< (填“>”或“<”)K2.
(3)某温度下,反应物的起始浓度[M]=1.0mol•L-1,[N]=2.4mol•L-1,达到平衡后,M的转化率为60%,此时N的转化率为25%,该反应的平衡常数Kc=0.5.
17.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已经达到平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 容器内总质量 | D. | 气体的总物质的量 |
14.下列括号中的分离方法运用得当的是( )
| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | CaCO3和CaCl2(溶解、过滤、蒸发) | D. | 泥水中的不溶性泥沙(萃取) |
1.某无色溶液中一定能大量共存的离子是( )
| A. | H+、Na+、NO3-、CO32- | B. | Na+、CO32-、Cu2+、Cl- | ||
| C. | K+、Na+、Cl-、NH4+ | D. | K+、Cl-、Ba2+、SO42- |
11.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 7.8 g Na2O2中存在的共价键总数为0.1NA | |
| B. | 2.4g石墨中含有C-C键个数为0.4NA | |
| C. | 标准状况下,22.4LCC14中所含分子数为NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
18.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
16.下列说法正确的是( )
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 水力发电是将化学能转化为电能的过程 | |
| C. | 可以通过化学反应完成16O到18O的转变 | |
| D. | 生铁、不锈钢、青铜都属于合金 |