题目内容
1.某无色溶液中一定能大量共存的离子是( )| A. | H+、Na+、NO3-、CO32- | B. | Na+、CO32-、Cu2+、Cl- | ||
| C. | K+、Na+、Cl-、NH4+ | D. | K+、Cl-、Ba2+、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.H+、CO32-结合生成气体和水,不能共存,故A错误;
B.CO32-、Cu2+结合生成沉淀,且Cu2+为蓝色,与无色不符,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.Ba2+、SO42-结合生成沉淀,不能共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
11.运用元素周期律分析,下列说法正确的是( )
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的最外层电子数等于元素的最高化合价 | |
| C. | 原子序数越大,原子半径越大 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
9.煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油和天然气为主要原料生产的合成材料是( )
| A. | 塑料 | B. | 玻璃 | C. | 淀粉 | D. | 合成纤维 |
16.下列溶液中的Na+与50mL1mol/LNa3PO4溶液中的Na+的物质的量浓度相等的是( )
| A. | 150mL3mol/LNaCl溶液 | B. | 75mL2mol/LNaNO3溶液 | ||
| C. | 150mL2mol/LNa2SO4溶液 | D. | 75mL1mol/LNa2S |
6.通常情况下,氯化钠、氯化艳、二氧化碳和二氧化硅的晶体结构分别如图所示:
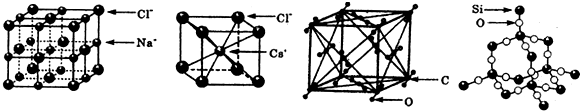
下列关于这些晶体结构和性质的叙述不正确的是( )

下列关于这些晶体结构和性质的叙述不正确的是( )
| A. | 干冰的晶胞中含有6个CO2分子 | |
| B. | 干冰是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| C. | 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 | |
| D. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
13.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.lmol/LCH3COONa溶液:c(Na+)═c(CH3COO-) | |
| B. | 0.1mol/LNa2CO3溶液:c(Na+)═c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向醋酸钠溶液加适量醋酸所得溶液:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+) |
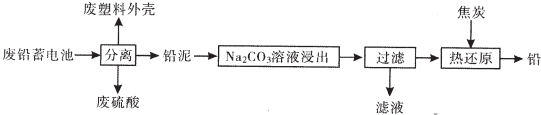
10.废铅蓄电池的一种回收利用工艺流程如图所示:
部分难溶电解质的性质如表:
回答下列问题:
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
11.反应C(s)+H2O(g)?CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入水蒸气使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 加入催化剂 |

 .
. 或
或 .(任写一种)
.(任写一种)