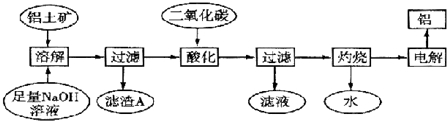
题目内容
11.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 7.8 g Na2O2中存在的共价键总数为0.1NA | |
| B. | 2.4g石墨中含有C-C键个数为0.4NA | |
| C. | 标准状况下,22.4LCC14中所含分子数为NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
分析 A.1molNa2O2中含有1mol共价键;
B.12g石墨中含有C-C键的物质的量为1mol×3×$\frac{1}{2}$=1.5mol;
C.标况下四氯化碳为液态;
D.Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol.
解答 解:A.1molNa2O2中含有1mol共价键,7.8 g Na2O2的物质的量为0.1mol,存在的共价键总数为0.1NA,故A正确;
B.2.4g石墨的物质的量为0.2mol,在石墨晶体中一个碳原子形成3个C-C键,每个C-C键由2个碳原子构成,因此12g石墨中含有C-C键的物质的量为1mol×3×$\frac{1}{2}$=1.5mol,C-C键的个数为0.3NA,故B错误;
C.标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.Fe3+在溶液中发生水解,Fe3+的物质的量小于0.1mol,所以溶液含有Fe3+数目小于0.1NA个,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意物质的结构是解题关键,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
2.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 大米、面包是碱性食物 | D. | 鱼、牛奶是酸性食物 |
19.下列化学反应的离子方程式正确的是( )
| A. | 铁粉和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 稀硫酸和Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | CuSO4和NaOH溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| D. | 单质铜和AgNO3溶液反应:Cu+2Ag+═Cu2++2Ag |
6.通常情况下,氯化钠、氯化艳、二氧化碳和二氧化硅的晶体结构分别如图所示:
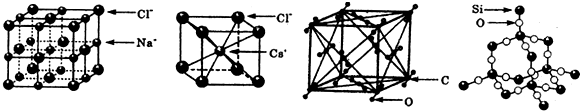
下列关于这些晶体结构和性质的叙述不正确的是( )

下列关于这些晶体结构和性质的叙述不正确的是( )
| A. | 干冰的晶胞中含有6个CO2分子 | |
| B. | 干冰是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| C. | 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 | |
| D. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
16.基态原子最外层电子排布为4s2的原子,其核外电子占有的原子轨道总数不可能是( )
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
3. 氨是一种重要的化工产品.
氨是一种重要的化工产品.
(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
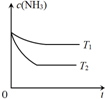
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则反应在该温度下平衡常数K=2.37(保留三三位有效数字);保持温度不变,30min时再向该密闭容器中投入0.5molN2、0.5molH2和1molNH3,此时反应将正向进行(填“正向进行”、“逆向进行”或“处于平衡状态”).
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 氨是一种重要的化工产品.
氨是一种重要的化工产品.(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+$\frac{1}{2}$O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)??H2(g)+$\frac{1}{2}$O2(g)△H=+249kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是BDE.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)反应2NH3(g)??N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1小于T2,平衡常数K(T1)小于K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为0.09mol.反应在0~5min区间的平均反应速率v(N2)=0.004mol/(L•min).
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
20.关于Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O的下列说法中,正确得是( )
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 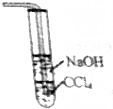 制备SO2装置尾气可用如图处理 |
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.