题目内容
5.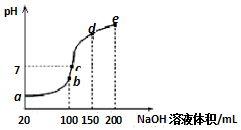 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
分析 向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液的过程中,首先发生反应H++OH-=H2O,b点恰好完全反应生成相同物质的量的(NH4)2SO4和Na2SO4,b点铵根离子水解导致溶液显酸性,b点后再加入NaOH溶液,发生反应OH-+NH4+=NH3•H2O,pH=7时,铵根离子水解程度与一水合氨电离程度相同,据电荷守恒分析D,据此解答.
解答 解:A、b点溶液为相同物质的量浓度的(NH4)2SO4和Na2SO4混合溶液,c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B、b点铵根离子水解导致溶液显酸性,b点后发生反应OH-+NH4+=NH3•H2O,图中b、c、d、三点溶液中水的电离程度最大的是b点,故B错误;
C、b点后再加入NaOH溶液,发生反应OH-+NH4+=NH3•H2O,NH3•H2O浓度逐渐增大,电离程度逐渐减小,故C正确;
D、根据电荷守恒可得:c(H+)+c(Na+ )+c(NH4+)=c(OH-)+2c(SO42-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断等知识,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、盐的水解原理在判断离子浓度大小中的应用方法以及弱电解质的浓度越小电离程度越大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
15.采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取绿矾(FeSO4•7H2O),某学习小组设计了如图流程:下列说法错误的是( )
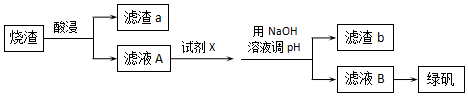

| A. | 酸浸时选用足量硫酸,试剂X为铁粉 | |
| B. | 滤渣a主要含SiO2,滤渣b主要含Al(OH)3 | |
| C. | 从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解 | |
| D. | 试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾 |
16.下列离子方程式错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | (NH4) 2Fe (SO4) 2溶液与过量NaOH 溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向 NaAlO2溶液中通过里 CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性 KMnO4 氧化 H2O2:MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
13.下列说法正确的是( )
| A. | HNO3是挥发性一元酸 | |
| B. | Al2O3是金属氧化物、也是碱性氧化物 | |
| C. | 氧气和臭氧的相互转化是物理变化 | |
| D. | 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来 |
20.下列有关实验说法正确的是( )
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
7.锌和浓度不同的硝酸会发生不同的反应,其中被氧化的锌和被还原的硝酸的微粒个数之比为3:2的是( )
| A. | Zn+HNO3(浓)--Zn(NO3)2+NO2↑+H2O | B. | Zn+HNO3(浓)--Zn(NO3)2+NO↑+H2O | ||
| C. | Zn+HNO3(很稀)--Zn(NO3)2+NO2↑+H2O | D. | Zn+HNO3(很稀)--Zn(NO3)2+NH4NO3+H2O |