题目内容
8.将SO2氧化为SO3是工业上生产硫酸的关键步骤.(1)某温度下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=3.33.
(2)该反应在450℃时的平衡常数大于(填“大于”“小于”或“等于”)500℃时的平衡常数.
(3)下列有关该反应的说法正确的是C(填序号).
A.保持容器的体积不变,当混合气体的密度不变时,说明反应已经达到平衡状态
B.达到平衡时若升高温度,混合气体中硫元素的质量分数将变大
C.达到平衡时若减小容器的体积,正反应速率将大于逆反应速率
D.达到平衡后,SO2的转化率和O2的转化率一定相等.
分析 (1)当反应达到平衡时共放出热量196kJ,可知参加反应的SO2为$\frac{196kJ}{98kJ/mol}$=2mol,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始 4 10 0
转化 2 1 2
平衡 2 9 2
结合平衡浓度计算K;
(2)该反应为放热反应,升高温度,平衡逆向移动,K减小;
(3)A.保持容器的体积不变,当混合气体的密度始终不变;
B.由质量守恒定律可知,混合气体中硫元素的质量分数不变;
C.达到平衡时若减小容器的体积,压强增大,平衡正向移动;
D.起始量之比不等于化学计量数之比.
解答 解:(1)当反应达到平衡时共放出热量196kJ,可知参加反应的SO2为$\frac{196kJ}{98kJ/mol}$=2mol,则
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始 4 10 0
转化 2 1 2
平衡 2 9 2
平衡浓度分别为0.02mol/L、0.09mol/L、0.02mol/L,
K=$\frac{0.02}{0.02×\sqrt{0.09}}$≈3.33,
故答案为:3.33;
(2)该反应为放热反应,升高温度,平衡逆向移动,K减小,则450℃时的平衡常数大于500℃时的平衡常数,
故答案为:大于;
(3)A.保持容器的体积不变,当混合气体的密度始终不变,不能判断平衡,故A错误;
B.由质量守恒定律可知,混合气体中硫元素的质量分数不变,故B错误;
C.达到平衡时若减小容器的体积,压强增大,平衡正向移动,则正反应速率将大于逆反应速率,故C正确;
D.起始量之比不等于化学计量数之比,则二者转化率不等,故D错误;
故答案为:C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算及平衡移动为解答本题的关键,侧重分析与应用的考查,注意物质的量与热量的关系,题目难度不大.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案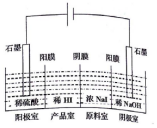 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )| A. | 通电后,阴极室溶液pH增大 | |
| B. | 阳极电极反应式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol产品HI,阳极室溶液质量减少8g | |
| D. | 通电过程中,NaI的浓度逐渐减小 |
| A. | 氨气溶于水能导电,所以氨气是电解质 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO2 | |
| C. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| D. | 所有铵盐受热均可以分解,产物均有NH3 |
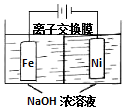 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )| A. | 电解一段时间后,阳极室的c(OH-)增大 | |
| B. | Na+由阴极室移向阳极室 | |
| C. | 阴极反应式:2H2O+2e-=H2↑+2OH- | |
| D. | 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2 |
| A. | 3mol C+1mol D | |
| B. | 1mol A+0.5mol B+1.5mol C+0.5mol D | |
| C. | 1mol A+0.5mol B+1.5mol C | |
| D. | 4mol A+2mol B |
| A. | 6.72L | B. | 4.48L | C. | 2.24L | D. | 1.12L |
| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
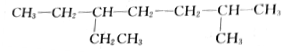 的名称是2-甲基-5-乙基庚烷
的名称是2-甲基-5-乙基庚烷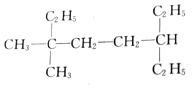 的名称是3,3-二甲基-6-乙基辛烷
的名称是3,3-二甲基-6-乙基辛烷 的名称是2-甲基-3,6-二乙基辛烷
的名称是2-甲基-3,6-二乙基辛烷 的名称是2,4,4,5-四甲基庚烷.
的名称是2,4,4,5-四甲基庚烷.