题目内容
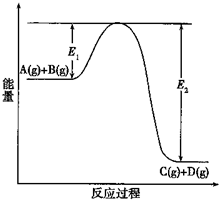 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.①图中该反应是
②当反应达到平衡时,升高温度,A的转化率
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
若1g水蒸气转化成液态水时放热2.444kJ,则H2的燃烧热△H=
考点:反应热和焓变,热化学方程式,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①根据反应物总能量和生成物总能量的关系判断反应热;△H=正反应的活化能-逆反应的活化能;
②升高温度使平衡向逆反应方向移动;
③加入催化剂能降低物质的活化能;催化剂对平衡无影响;
(2)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;
②升高温度使平衡向逆反应方向移动;
③加入催化剂能降低物质的活化能;催化剂对平衡无影响;
(2)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;
解答:
解:(1)①由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应;△H=正反应的活化能-逆反应的活化能,即△H=E1-E2;
故答案为:放热;△H=E1-E2;
②当反应达到平衡时,该反应正反应为放热反应,升高温度使平衡向逆反应方向移动,A的转化率减小,故答案为:减小;
③加入催化剂能降低反应物质的活化能,则E1和E2都减小;催化剂能加快反应速率但不改变平衡的移动;
故答案为:减小;减小;不;
(2)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol;
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+
O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol;
故答案为:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol;-285.5;
故答案为:放热;△H=E1-E2;
②当反应达到平衡时,该反应正反应为放热反应,升高温度使平衡向逆反应方向移动,A的转化率减小,故答案为:减小;
③加入催化剂能降低反应物质的活化能,则E1和E2都减小;催化剂能加快反应速率但不改变平衡的移动;
故答案为:减小;减小;不;
(2)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+
| 1 |
| 2 |
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查催化剂对反应的影响、热化学方程式的书写与反应热的计算,难度不大,注意掌握热化学方程式的书写,物质聚集状态的分析判断,盖斯定律的计算应用,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
下列有关CuSO4?5H2O的叙述正确的是( )
| A、1mol CuSO4?5H2O的质量为250g/mol |
| B、CuSO4?5H2O的摩尔质量为250g |
| C、CuSO4?5H2O的摩尔质量为250g/mol |
| D、配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4?5H2O 1.6g |
 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示: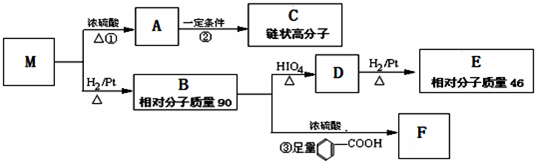

 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题: