题目内容
10.已知在通常状况下,1molCH4完全燃烧能放出890kJ热量.天然气的主要成分是甲烷,请以甲烷为依据:(1)粗略计算16kg天然气完全燃烧产生的热量是多少?
(2)已知使1kg水的温度升高1℃需热量4.18kJ,试计算烧开10L水,至少需要消耗甲烷的体积(标准状况下).
分析 (1)16kg天然气物质的量近似为$\frac{16g}{16g/mol}$×103=1000mol;
(2)10L水质量近似为10Kg,计算烧开水需要的热量,通常状况下,1molCH4完全燃烧能放出890kJ热量计算得到甲烷的物质的量,由此计算气体标准状况下的体积.
解答 解:(1)16kg天然气物质的量近似为$\frac{16g}{16g/mol}$×103=1000mol,1molCH4完全燃烧能放出890kJ热量,1000mol甲烷完全燃烧放出热量890000KJ,
答:16kg天然气完全燃烧产生的热量是890000KJ;
(2)10L水质量近似为10Kg,使1kg水的温度升高1℃需热量4.18kJ,计算烧开水需要的热量=10×(100-25)×4.18KJ=3135KJ,1molCH4完全燃烧能放出890kJ热量,则甲烷物质的量=$\frac{3135KJ}{890KJ/mol}$=3.52mol,标准状况下体积=3.52mol×22.4L/mol=78.9L,
答:烧开10L水,至少需要消耗甲烷的体积78.9L.
点评 本题考查了好像反应热量变化的计算,注意题干条件的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
此时反应的正、逆反应速率的关系是:v(正)<v(逆)(填“>”“<”或“═”).
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CDE.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
15.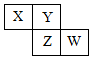 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
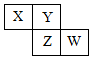 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
2.下列叙述中正确的是( )
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
20.N2H4是一种高效清洁的火箭燃料.已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是( )
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
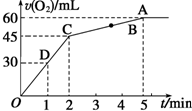 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.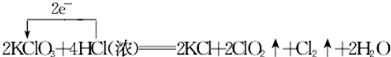 .
. C和Si元素在化学中占有极其重要的地位:
C和Si元素在化学中占有极其重要的地位: