题目内容
5.完成下列填空:(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.该反应中还原剂是C,氧化剂是S、KNO3.
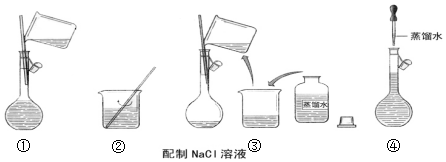
(2)某班同学在玩密室逃脱游戏时,有一个密码锁,需要四个数字的密码开锁,一学生找到一张任务卡如图,则该密码为:②③①④
(3)现有下列物质:①Cu ②HCl ③NH3 ④NaCl ⑤CaCO3 ⑥稀硫酸 ⑦NaHSO4,其中属于电解质,但熔融状态下并不导电的是②(填序号),请写出NaHSO4在水溶液中的电离方程式NaHSO4=Na++H++SO42-
(4)写出制备Fe(OH)3胶体的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,向该胶体中逐滴加入稀硫酸的现象为先产生红褐色沉淀,后来沉淀消失,发生反应的离子方程式为Fe(OH)3+3H+=Fe3++3H2O
(5)在25℃,101kPa条件下,将15L O2通入10L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.(1)若剩余气体的体积是15L,则通入10L CO和H2的混合气体中,V(CO)=5L,V(H2)=5L.若剩余气体的体积为a L,则a的取值范围是10<a<20.
分析 (1)该反应中,硫元素化合价由0价变为-2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,根据元素化合价变化判断氧化剂和还原剂,氧化剂在反应中被还原,还原剂在反应中被氧化,以此解答;
(2)根据配制一定物质的量浓度的溶液步骤排序;
(3)属于电解质,但熔融状态下并不导电的为共价化合物的电解质;硫酸氢钠为强电解质,在溶液中完全电离出钠离子、氢离子和硫酸根离子;
(4)氯化铁溶液加热水解生成氢氧化铁胶体和氯化氢;氢氧化铁胶体带有正电荷,加热稀硫酸后先发生聚沉现象生成氢氧化铁沉淀,然后氢氧化铁沉淀与稀硫酸发生酸碱中和反应生成氯化铁和水;
(5)CO、氢气完全燃烧,先设出CO气体的xL,则氢气为(10-x)L,利用方程式根据差量法表示出体积变化量,再根据剩余的气体的体积列方程计算混合物中气体的体积;由$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-a计算a的表达式,结合0<x<10计算.
解答 解:(1)反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到-2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,
故答案为:C;S、KNO3;
(2)配制一定物质的量浓度的NaCl溶液步骤为称量、溶解、冷却、移液、洗涤、定容等,所以正确的顺序为:②③①④,
故答案为:②③①④;
(3)①Cu ②HCl ③NH3 ④NaCl ⑤CaCO3 ⑥稀硫酸 ⑦NaHSO4,其中属于电解质,但熔融状态下并不导电的物质一定为共价化合物型的电解质,满足体积的有②;
NaHSO4在水溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:②;NaHSO4=Na++H++SO42-;
(4)将饱和氯化铁溶液加入沸水中加热制备Fe(OH)3胶体,反应的化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3 HCl; 向该胶体中逐滴加入稀硫酸,氢氧化铁胶体先发生聚沉现象生成氢氧化铁沉淀,然后氢氧化铁沉淀与稀硫酸反应生成硫酸铁和水,反应反应为:Fe(OH)3+3H+=Fe3++3H2O,反应现象为:先产生红褐色沉淀,后来沉淀消失,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3 HCl;先产生红褐色沉淀,后来沉淀消失;Fe(OH)3+3H+=Fe3++3H2O;
(5)设V(CO)为xL,则V(H2)为(10-x)L,
由2CO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2 △V
2 1 2 1
x $\frac{x}{2}$
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O△V
2 1 3
(10-x) $\frac{3}{2}$(10-x)
则$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-15,解得:x=5,
即V(CO)=5L,则V(H2)=(10-x)L=10L-5L=5L,
混合气体中CO与剩余气体体积a之间的关系为:$\frac{1}{2}$x+$\frac{3}{2}$(10-x)=15+10-a,
解得:a=10+x,
由于0<x<10,则10<a<20,
故答案为:5;5;10<a<20.
点评 本题考查较为综合,涉及混合物反应的计算、氧化还原反应、离子方程式的书写等知识,题目难度中等,(5)为易错点,明确反应前后体积的变化及该条件下水的状态是关键,学生容易忽略水为液体而导致分析错误,注意差量法的利用,简化计算过程.

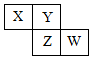 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267kJ/mol | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ/mol | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534kJ/mol | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol |
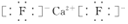 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.