题目内容
9.下列离子反应方程式正确的是( )| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
分析 A.氨水为弱碱,不会溶解氢氧化铝,则二者反应生成氢氧化铝沉淀;
B.离子方程式两边不满足电荷守恒、电子守恒;
C.磁性氧化铁为四氧化三铁,离子方程式中四氧化三铁不能拆开;
D.碱性锌锰电池总反应Zn+2MnO2十H2O=ZnO+2MnO(OH)可知,Zn被氧化,为原电池的负极,电极反应为Zn-2e-+2OH-=ZnO+H2O;MnO2被还原,为原电池正极,电极反应为:MnO2+H2O+e-=MnO(OH)+OH-.
解答 解:A.向Al2(S04)3溶液中加入过量氨水,氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.少量双氧水滴人酸性KI溶液,二者发生氧化还原反应,正确的离子方程式为:H202+2H++2I-═2H20+I2,故B错误;
C.将磁性氧化铁溶于足量稀硝酸中,四氧化三铁不能拆开,正确的离子反应为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故C错误;
D.碱性锌锰电池中正极上得电子发生还原反应,电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH-,故D正确;
故选D.
点评 本题考查了离子方程式书写方法,题目难度中等,涉及原电池原理、离子方程式书写方法,明确离子方程式书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.能正确表示下列反应的离子反应方程式为( )
| A. | NH4HCO3稀溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-→2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3→Ca2++CO2↑+H2O |
14.下列说法不正确的是( )
| A. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
1.下列实验操作能达到目的是( )
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |
18.生活处处有化学.下列说法正确的是( )
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
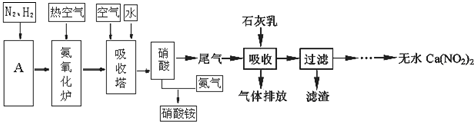
 CO+3H2.
CO+3H2.
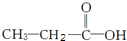 和
和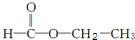 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.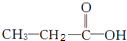 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.