题目内容
17.能正确表示下列反应的离子反应方程式为( )| A. | NH4HCO3稀溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-→2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3→Ca2++CO2↑+H2O |
分析 A.氢氧化钾过量,铵根离子、碳酸氢根离子都反应;
B.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子;
C.氯气足量,二价铁离子、溴离子都被氧化;
D.醋酸为弱酸,应保留化学式;
解答 解:A.NH4HCO3稀溶液与过量的KOH溶液反应,离子方程式:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O,故A正确;
B.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.向FeBr2溶液中通入足量氯气,离子方程式:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl-,故C正确;
D.醋酸除去水垢,离子方程式:2CH3COOH+CaCO3→Ca2++CO2↑+H2O+2CH3COO-,故D错误;
故选:AC.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项BC为易错选项.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
7.下列反应中,属于吸热反应的是( )
| A. | Na与H2O的反应 | B. | Al与Fe2O3的反应 | ||
| C. | 石灰石高温分解 | D. | NaOH与HCl的反应 |
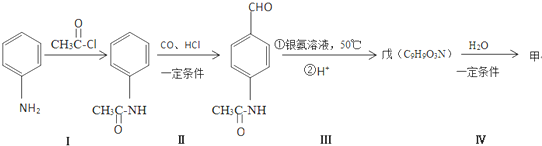
8.目前工业上多用CO制备甲酸,其主要过程如下:
流程一:
流程二:
下列说法正确的是( )
流程一:

流程二:

下列说法正确的是( )
| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
5.有关晶体的下列说法中正确的是( )
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 分子晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰熔化时水分子中共价键发生断裂 | |
| D. | CaCl2晶体中含有两种化学键 |
12.关于如图装置中的变化叙述错误的是( )
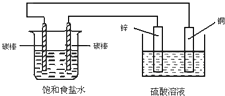

| A. | 电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片 | |
| B. | 铜片上发生氧化反应 | |
| C. | 右侧碳棒上发生的反应:2H++2e→H2↑ | |
| D. | 铜电极出现气泡 |
9.下列离子反应方程式正确的是( )
| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
6. 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
(1)已知:2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
①该反应的△H<0.(填“>”、“=”或“<”).
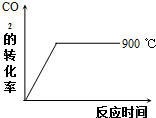
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.
其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
(3)以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:(1)已知:2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.
其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
7.下列有关物质(括号内为杂质)的除杂试剂和分离方法均正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 .
.
 .
.