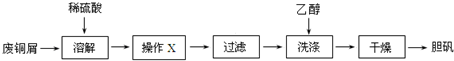
题目内容
5.下列实验装置不能达到实验目的是( )| A. |  验证沉淀转化 | B. |  除去苯中的苯酚 | ||
| C. |  观察铁的吸氧腐蚀 | D. |  检验乙炔的还原性 |
分析 A.白色沉淀转化为红褐色沉淀;
B.苯酚与NaOH反应后,与苯分层;
C.NaCl溶液为中性,发生吸氧腐蚀;
D.反应生成的乙炔中混有硫化氢,均能被高锰酸钾氧化.
解答 解:A.白色沉淀转化为红褐色沉淀,则可说明沉淀的转化,故A正确;
B.苯酚与NaOH反应后,与苯分层,然后利用图中分液漏斗分离,故B正确;
C.NaCl溶液为中性,发生吸氧腐蚀,则右侧试管中导管内红墨水上升,故C正确;
D.反应生成的乙炔中混有硫化氢,均能被高锰酸钾氧化,不能检验乙炔的还原性,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验装置的作用为解答的关键,侧重分析与应用能力的考查,注意反应原理的分析与应用,题目难度不大.

练习册系列答案
相关题目
16.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
10.下列有关物质性质和应用的因果关系正确的是( )
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| C. | 硅具有还原性,一定条件下能将铁从其氧化物中置换出来 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
 现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.
现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.

 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )