题目内容
13.无论从能耗,还是环境,现代工业工艺往往采用联合生产的方式.工业合成氨、硝酸、纯碱可以进行联合生产.请回答下列有关问题:(1)工业中,从合成塔出来的混合气体成分是NH3、H2、N2(填化学式),在进入分离器之前,需进入冷却塔(填工业设备名称).
(2)15mol氮气和3mol氢气在密闭容器中反应生成的氨气的物质的量a(选填字母代号).
a.小于2mol b.等于2mol c.大于2mol 小于15mol d.等于15mol
(3)氨气在工业制备硝酸生产中的作用是4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O(用化学方程式表示):硝酸工业生产中的尾气(NO2、NO的混合气体)通常可用纯碱溶液吸收:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑;尾气吸收过程中,每吸收5mol尾气,则生成CO2的物质的量为2.5mol;
(4)硝酸厂的尾气也可利用尿素蒸汽将氨的氧化物还原为空气的主要成分而除去,写出尿素与NO2反应的化学方程式4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
分析 (1)工业中,从合成塔出来的混合气体成分是NH3、H2、N2;在进入分离器之前,需进入冷却塔;
(2)根据可逆反应的特点分析解答;
(3)氨气在工业制备硝酸生产中的作用氨气与氧气反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;由反应方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾气生成1mol的二氧化碳,所以每吸收5mol尾气,则生成CO2的物质的量为2.5mol;
(4)尿素与NO2反应生成氮气和二氧化碳气体,反应的方程式为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
解答 解:(1)工业中,从合成塔出来的混合气体成分是NH3、H2、N2;在进入分离器之前,需进入冷却塔,故答案为:NH3、H2、N2;冷却塔;
(2)根据可逆反应不可能完全转化,如果3mol氢气完全转化生成2mol的氨气,所以生成的氨气的物质的量小于2mol,故选a;
(3)氨气在工业制备硝酸生产中的作用氨气与氧气反应生成一氧化氮和水,反应的化学方程式为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;由反应方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,NO+NO2+Na2CO3=2NaNO2+CO2↑可知,2mol的尾气生成1mol的二氧化碳,所以每吸收5mol尾气,则生成CO2的物质的量为2.5mol,故答案为:4NH3+O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O;2.5mol;
(4)尿素与NO2反应生成氮气和二氧化碳气体,反应的方程式为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O,故答案为:4CO(NH2)2+6NO2=7N2+4CO2+8H2O.
点评 本题考查了含氮物质的应用,题目难度中等,明确工业制取硝酸的原理为解答关键,注意掌握含氮物质的性质及综合应用方法,试题培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
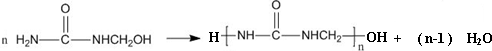
(尿素)
(电玉)
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 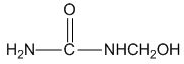 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
| A. |  验证沉淀转化 | B. |  除去苯中的苯酚 | ||
| C. |  观察铁的吸氧腐蚀 | D. |  检验乙炔的还原性 |
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
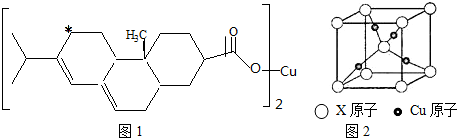
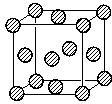 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.