题目内容
14.实验室用环戊醇(沸点160.8℃,密度0.96g/mL)与溴化氢反应制备溴代环戊烷(沸点138℃,密度1.37g/mL),其反应原理如下: OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
分析 根据反应原理: OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,制取溴代环戊烷反应条件为需水浴控制温度,需温度计,据此选择装置.
Br+NaHSO4+H2O,制取溴代环戊烷反应条件为需水浴控制温度,需温度计,据此选择装置.
解答 解:用环戊醇(沸点160.8℃,密度0.96g/mL)与溴化氢反应制备溴代环戊烷(沸点138℃,密度1.37g/mL),其反应原理如下: OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷,需水浴加热,且需用温度计控制反应的温度为75-80℃,装置A、D未进行水浴,且A无温度计,故A、D不选;B装置缺少温度计,故B不选,只有装置C条件都符合,
Br+NaHSO4+H2O,则制备溴代环戊烷,需水浴加热,且需用温度计控制反应的温度为75-80℃,装置A、D未进行水浴,且A无温度计,故A、D不选;B装置缺少温度计,故B不选,只有装置C条件都符合,
故选C.
点评 本题考查了制取装置的选择,题目难度不大,注意从其反应原理得出反应条件进行装置选择是解答关键,试题培养了学生灵活应用信息的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列实验装置不能达到实验目的是( )
| A. |  验证沉淀转化 | B. |  除去苯中的苯酚 | ||
| C. |  观察铁的吸氧腐蚀 | D. |  检验乙炔的还原性 |
9.短周期主族元素甲、乙、丙在周期表中的相对位置如图所示,下列说法一定正确的是( )
| 丙 | ||
| 甲 | 乙 |
| A. | 单质熔沸点从高到低:甲>乙>丙 | B. | 气态氢化物的热稳定性:丙>甲>乙 | ||
| C. | 元素最高价态:丙>乙>甲 | D. | 原子半径从大到小:甲>乙>丙 |
6.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | E的单质氧化性最强 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
3.铁元素是重要的金属元素,铁单质及化合物在工业和生活中也有广泛的用途.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
达平衡后,若再加入四种物质,各物质的物质的量如下表:
当重新达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A(用A、B、C表示).
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
(1)在实验室中,FeCl2可用铁粉和盐酸反应制备,FeCl3可用铁粉和氯气反应制备.
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应制取K2FeO4,其反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.与MnO2-Zn电池类似,K2FeO4-Zn也可组成碱性电池,该电池的总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(3)铁与水反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<0上述反应的平衡常数表达式K=$\frac{[{H}_{2}]{\;}^{4}}{[{H}_{2}O]^{4}}$.
(4)若在2L恒容绝热(不与外界交换能量)装置中,按下表充入起始物质,起始时与平衡后的物质的物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下:Fe(OH)3的Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12,若将MgCl2、FeCl3均为0.1mol•L-1混合溶液中的pH用MgO调节至pH=4,则溶液中$\frac{c(M{g}^{2+})}{c(F{e}^{3+})}$比值约为108.
10.下列说法不正确的是( )
| A. | 近年来禽流感病毒H7N9时有病例报告,卫生部门强调要尽量避免接触活禽,个人也应加强消毒预防,其中消毒剂可以选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| B. | 将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内是为了催熟水果 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 用二氧化碳制全降解塑料,可以缓解温室效应 |





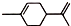 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为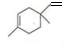 .
.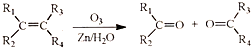 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)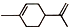 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式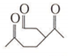 .
.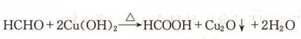 .
.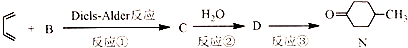
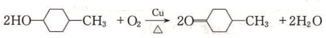 .
.