题目内容
2.1mol乙烯和氯气发生加成反应生成氯乙烷,该氯乙烷继续和Cl2发生取代反应,最多可再消耗Cl2的物质的量为( )| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
分析 乙烯含碳碳双键,与氯气以1:1反应,烷烃中H被Cl取代,取代的氢原子的物质的量与氯气的物质的量相等,以此来解答.
解答 解:由C2H4+Cl2→CH2ClCH2Cl,则1mol乙烯与氯气发生加成反应需要Cl21mol;
CH2ClCH2Cl+4Cl2$\stackrel{光照}{→}$CCl3CCl3+5HCl,所以1molCH2ClCH2Cl与氯气发生取代反应,最多可再消耗Cl2的物质的量为4mol,
故选A.
点评 本题考查化学反应的计算,为高频考点,把握有机物的性质、发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意该题为计算取代反应需要的氯气,题目难度不大.

练习册系列答案
相关题目
1.纯碱(Na2CO3)属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
2.若某地每升海水中含钠元素11.5g,则该海水中氯化钠(设钠都以氯化钠的形式存在)的含量为( )
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
10.在某温度时,水的离子积为1×10-12 mol2•L-2,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液( )①呈碱性 ②呈酸性 ③[H+]=100[OH-]④[OH-]=100[H+]⑤呈中性.
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
17.下列说法正确的是( )
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 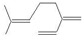 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
7.表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
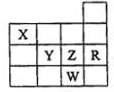

| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
11.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
12.如表表示元素周期表的一部分,回答下列有关问题(要求用化学用语):
(1)写出下列元素符号:dMg、iAr.
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.
| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.