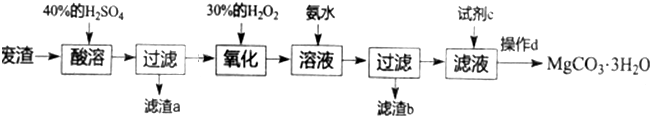
题目内容
10.在某温度时,水的离子积为1×10-12 mol2•L-2,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液( )①呈碱性 ②呈酸性 ③[H+]=100[OH-]④[OH-]=100[H+]⑤呈中性.| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
分析 某温度时,水的离子积为1×10-12 mol2•L-2,中性溶液中H+浓度为1×10-6mol•L-1,若该温度下某溶液中H+浓度为1×10-7 mol•L-1<1×10-6mol•L-1,可知溶液显碱性,以此来解答.
解答 解:某温度时,水的离子积为1×10-12 mol2•L-2,中性溶液中H+浓度为1×10-6mol•L-1,若该温度下某溶液中H+浓度为1×10-7 mol•L-1<1×10-6mol•L-1,可知溶液显碱性,OH-的浓度为$\frac{1×1{0}^{-12}}{1×1{0}^{-7}}$=1×10-5mol•L-1,则-]④[OH-]=100[H+],
故选A.
点评 本题考查溶液酸碱性的判断,为高频考点,把握水的电离平衡常数、氢离子的计算为解答的关键,侧重分析与计算能力的考查,注意中性溶液中离子浓度的判断,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
2.1mol乙烯和氯气发生加成反应生成氯乙烷,该氯乙烷继续和Cl2发生取代反应,最多可再消耗Cl2的物质的量为( )
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
20.已知:
Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |




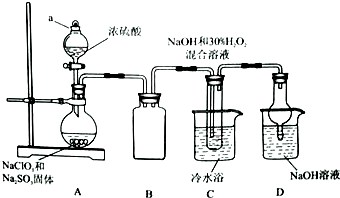 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷.