题目内容
12.如表表示元素周期表的一部分,回答下列有关问题(要求用化学用语):| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
(2)k原子的电子层数为4,f原子最外层电子数为4.
(3)这11种元素中,单质的化学性质最稳定的是Ar.
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3(写化学式);写出它们两两反应的化学方程式:HClO4+KOH=KClO4+H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O.
(5)证明c、d原子失电子能力强弱的实验方法是Na与冷水反应生成氢气比Mg更剧烈;证明g、h原子得电子能力强弱的方法(用离子方程式表示)是H2S+Cl2=2H++S↓+2Cl-.
分析 根据各元素在周期表中的相对位置可知,a为N、b为F、c为Na、d为Mg、e为Al、f为Si、g为S、h为Cl、i为Ar、j为K、k为Ca元素,
(1)根据分析判断d、i的元素符号;
(2)原子的电子层数等于元素的周期序数;主族元素的最外层电子数等于其主族序数;
(3)稀有气体最外层满足稳定结构,化学性质比较稳定;
(4)氟元素没有最高价含氧酸,上述元素中最高价氧化物对应的水化物中酸性最强的是高氯酸;钾的金属性最强,故氢氧化钾的碱性最强;氢氧化铝能够与酸和强碱溶液反应,具有两性;分别写出氢氧化钾与氢氧化铝、氢氧化铝与高氯酸、氢氧化铝与高氯酸反应的化学方程式;
(5)金属单质越活泼,与水反应越剧烈,据此可判断Na、Mg的金属性强弱;通过非金属性单质之间的置换反应可以比较得电子能力强弱.
解答 解:根据各元素在周期表中的相对位置可知,a为N、b为F、c为Na、d为Mg、e为Al、f为Si、g为S、h为Cl、i为Ar、j为K、k为Ca元素,
(1)根据分析可知,d为Mg、i为Ar,
故答案为:Mg;Ar;
(2)k为Ca元素,位于第四周期,其原子的电子层数为4,f为Si元素,位于ⅣA族,其原子最外层电子数为4,
故答案为:4;4;
(3)这11种元素中,单质的化学性质最稳定的是稀有气体Ar,
故答案为:Ar;
(4)上述元素中除F(F没有正价)外Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强;Al(OH)3为两性氢氧化物;HClO4与KOH反应生成KClO4和H2O,反应的化学方程式为:HClO4+KOH=KClO4+H2O;HClO4与Al(OH)3反应生成Al(ClO4)3和H2O,反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;氢氧化铝具有两性,与KOH溶液反应生成偏铝酸钾和水,该反应方程式为:Al(OH)3+KOH=KAlO2+2H2O,
故答案为:HClO4;KOH;Al(OH)3;HClO4+KOH=KClO4+H2O;Al(OH)3+3HClO4=Al(ClO4)3+3H2O;Al(OH)3+KOH=KAlO2+2H2O;
(5)c、d分别为Na、Mg,钠与水反应比Mg与水反应剧烈,证明金属性Na>Mg,即Na失电子的能力大于Mg;
g、h分别为S、Cl元素,根据反应H2S+Cl2=2H++S↓+2Cl-可知单质氧化性Cl2>S,则得电子能力Cl>S,
故答案为:Na与冷水反应生成氢气比Mg更剧烈;H2S+Cl2=2H++S↓+2Cl-.
点评 本题考查了原子结构与元素周期律的关系及应用,题目难度中等,明确原子结构与元素周期表的关系为解答关键,注意掌握元素周期律内容,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
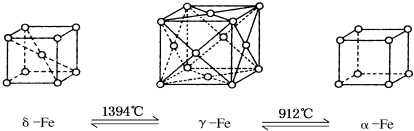
| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2SiO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 因为NH3•H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |

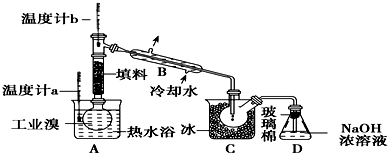
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
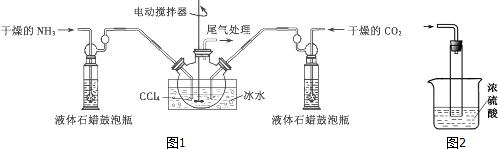
.
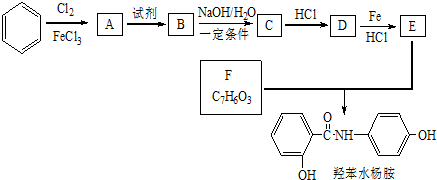
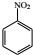 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
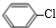 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.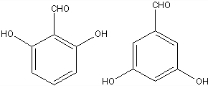 、
、 .
.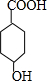 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$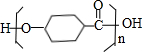 +(n-1)H2O.
+(n-1)H2O.